
下列有关物质的性质和应用都正确的是
A.氢氟酸具有强酸性,可用于雕刻玻璃
B.氨气显碱性,可用碱石灰或无水CaCl2干燥
C.MgO、A12O3熔点高,它们都可用于制作耐火材料
D.铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2014-2015湖北省高一3月月考化学试卷(解析版) 题型:填空题
(12分)高纯二氧化硅可用来制造光纤。某稻壳灰的成分为:
组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.61 |
通过如下流程可由稻壳灰制备较纯净的二氧化硅。
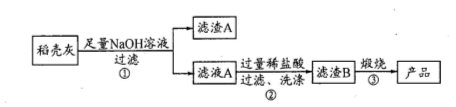
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有 类。
(2)步骤①中涉及SiO2的离子反应方程式为 。
(3)滤渣A的成分有 (填化学式)
(4)步骤③反应的化学方程式为: ;
(5)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、 和 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:填空题
(16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g)  2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
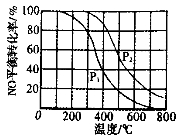
①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)

(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)  2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。

②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:填空题
(8分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)Cl2的电子式是 。新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是 ,漂白粉是一种 (填“混合物”或“纯净物”)。
(2)碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是 。
(4)已知:X2(g)+H2(g)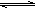 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
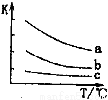
① H表示X2与H2反应的晗变,H 0。(填“>”、“<”或“=”)
H表示X2与H2反应的晗变,H 0。(填“>”、“<”或“=”)
②曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与T的关系。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、W、Z的原子序数依次增大。其中X、Z同主族,Z的单质是一种良好的半导体材料,W3+与Y2—具有相同的核外电子数。下列叙述正确的是
A.Y2—的离子半径大于W3+的离子半径
B.Y、Z形成的化合物为离子化合物
C.Z的最高价氧化物对应的水化物的酸性比X的强
D.X的气态简单氢化物的稳定性比Y的强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:填空题
【化学---选修2:化学与技术(15分)】MgSO4·7H2O在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100 g水)
温度/ ℃ | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)沉淀C的化学式是
(2)过滤Ⅲ需趁热过滤的理由是
(3)操作Ⅰ和操作Ⅱ的名称分别为 、
(4)滤液I中加入硼镁泥,调节溶液的pH=5~6,可除去滤液Ⅰ中 (填离子符号);加入NaClO溶液加热煮沸,可将Fe2+氧化成Fe3+的同时,还会将溶液中的Mn2+氧化成MnO2,写出Mn2+被氧化成MnO2的离子反应方程式为
(5)硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣。将硼镁矿(Mg2B2O5·H2O)煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应,试写出反应方程式
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:选择题
下列解释实验事实的化学方程式或离子方程式正确的是
A.用pH试纸检测,氨水溶液呈碱性: NH3·H2O  NH4+ +OH—
NH4+ +OH—
B.100 ℃时,测得纯水中c(H+)·c(OH—) =1×10—12:H2O(l) H+(aq)+OH—(aq)
H+(aq)+OH—(aq) 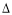 H<0
H<0
C.FeCl3溶液中通入适量SO2,溶液黄色褪去:2Fe3++SO2 +2H2O  2Fe2++SO42—+ 4H+
2Fe2++SO42—+ 4H+
D.向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O → 2C6H5OH+Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:实验题
(15分)焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂。
某研究小组对焦亚硫酸钠进行如下研究:
(1)采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。
装置Ⅱ中有Na2S2O5析出,发生的化学反应方程式为:Na2SO3 + SO2 = Na2S2O5。
①装置Ⅰ中产生气体的化学方程式为 。
②要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
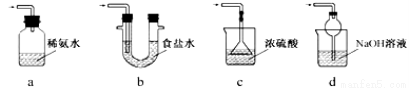
(2)【查阅资料】Na2S2O5溶于水即生成NaHSO3。
①NaHSO3溶液显酸性。请用化学用语和必要的文字解释原因________________________________;
证明该结论可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
②检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________。
(3)焦亚硫酸钠(Na2S2O5)在酸性条件下可将工业废水中的Cr2O72—还原为Cr3+。
①写出该反应的离子方程式_______________________。
②若处理Cr2O72—浓度为1×10-3mol/L的工业废水1L,需用Na2S2O5固体_________mg。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省台州市高三3月调研考试理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、M的原子序数依次增大,X、Z同主族,Z、W、M同周期,其中X 与Y能形成两种物质,且常温下均为液体。W的氧化物既能溶于强碱溶液,又能溶于X、M形成的水溶液。已知W与M形成的物质在178°C时升华。下列说法不正确的是
A.Z、W、M的原子半径由大到小的顺序为Z>W>M
B.M分别与Z、W所形成的物质的晶体类型相同
C.X2Y2易溶于X2Y中,是由于X2Y2与X2Y能形成分子间氢键
D.将Z2Y在空气中加热可得到Z2Y2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com