
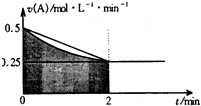
 某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )
某溶液中发生反应:A═2B+C,A的反应速率v(A)与时间t的图象如图所示.若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是( )| A. | 图中阴影部分的面积表示0-2min内A的物质的量浓度的减小值 | |
| B. | 反应开始的前2min,A的平均反应速率小于0.375mol•L-1•min-1 | |
| C. | 至2min时,A的物质的量减小值介于0.5mol至1mol之间 | |
| D. | 至2min时,c(B)介于1mol•L-1 至1.5mol•L-1 之间 |
分析 图象中阴影部分的面积的含义是指横、纵两坐标变化量的乘积,即浓度变化,此图象中的阴影部分的面积为反应物A浓度的减小值(0~2min);
根据图象可知,阴影部分的面积△c(A)的范围为:0.25 mol?L-1?min-1×2min=0.5mol?L-1<△c(A)<0.25 mol?L-1?min-1×2min+$\frac{1}{2}$×0.25 mol?L-1?min-1×2min=0.75mol?L-1;
A.根据分析可知,阴影部分的面积表示的是0~2min内A的物质的量浓度的减小值;
B.根据v=$\frac{△c}{△t}$可以计算出A的平均反应速率的范围;
C.阴影部分的面积表示的是物质的量浓度的变化,表示物质的量的变化;
D.根据A的浓度变化及反应方程式计算出B的浓度变化.
解答 解:图象中的阴影部分的面积的含义是指横、纵两坐标变化量的乘积,即浓度变化,此图象中的阴影为反应物A浓度的减小值(0~2min);
根据图象可知,阴影部分的面积:0.25 mol?L-1?min-1×2min=0.5mol?L-1<△c(A)<0.25 mol?L-1?min-1×2min+$\frac{1}{2}$×0.25 mol?L-1?min-1×2min=0.75mol?L-1,
A.根据以上分析可知,图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值,故A正确;
B.根据分析可知,A在0~2min浓度变化小于0.75mol/L,则该时间段A的反应速率一定小于:$\frac{0.75mol/L}{2min}$=0.375 mol?L-1?min-1,故B正确;
C.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值,不是物质的量的减小值,故C错误;
D.物质的量变化与化学计量数成正比,则2min时,B的物质的量浓度c(B)介于:0.5mol/L×2=1mol/L1和0.75mol/L×2=1.5mol/L之间,故D正确;
故选C.
点评 本题考查了化学反应速率的变化曲线及其应用,题目难度中等,正确理解图象中阴影部分的面积所表示的含义为解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液 | B. | 氯化钡溶液与硫酸钾溶液 | ||
| C. | 碳酸钡与稀硫酸 | D. | 氢氧化钡溶液与硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
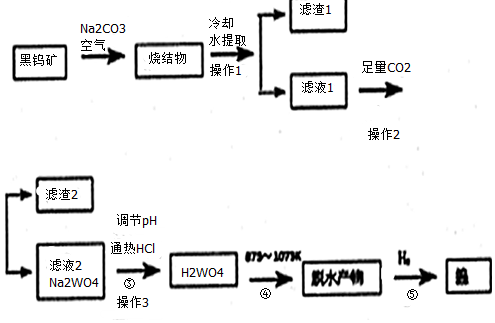
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 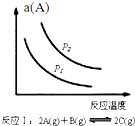 如图反应:△H<0,P2>P1 | |
| B. |  如图反应:△H<0,T1>T2 | |
| C. |  如图反应:△H>0,T2>T1 | |
| D. |  如图反应:△H>0,T2>T1或△H<0,T2<T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
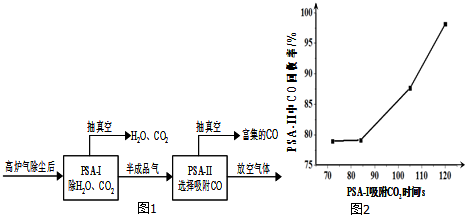
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (m+n)必定小于 p | B. | (m+n)必定大于 p | C. | m 必定小于 p | D. | n 必定大于 p |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1=2Q2=92.4 | B. | Ql>2Q2 | C. | Q1<2Q2 | D. | Q1=2Q2>92.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com