
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
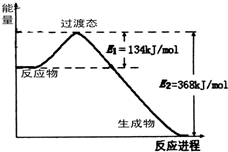 能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料. 查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)已知碳的燃烧热△H=-393.5KJ/mol,完全燃烧10mol碳释放的热量为 KJ。
(2)实验测得6.4 g 乙醇在氧气中充分燃烧生成CO2(g)和H2O(l)时释放出113.5KJ的热量,试写出乙醇燃烧热的热化学方程式:
(3)从化学键的角度分析,化学反应的实质就是反应物的化学键的断裂和生成物的化学键的形成过程。已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 (g)+ 3H2(g) ![]() 2NH3 (g) ΔH = -92.4 KJ/mol,则 N≡N 键的键能是 KJ/mol
2NH3 (g) ΔH = -92.4 KJ/mol,则 N≡N 键的键能是 KJ/mol
(4)下图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1的变化是_______(填“增大”、“减小”或“不变”),对反应热是否有影响?__________,原因是_________

(5)根据以下3个热化学方程式,判断Q1、Q2、Q3三者大小关系是
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H = Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H = Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H = Q3 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com