硫酸工业中2SO
2(g)+O
2(g)
2SO
3(g);△H<0(放热反应)有关实验数据如下:
压强
SO2的
转化率
温度 |
1×105 Pa |
5×105 Pa |
10×105 Pa |
50×105 Pa |
100×105 Pa |
| 450℃ |
97.5% |
98.9% |
99.2% |
99.6% |
99.7% |
| 550℃ |
85.6% |
92.9% |
94.9% |
97.7% |
98.3% |
(1)在生产中常用过量的空气是为了
使平衡正向移动,提高SO2的转化率
使平衡正向移动,提高SO2的转化率
.
(2)高温对该反应有何影响?
高温使反应速率加快,缩短了达到平衡所需的时间,但是对SO2的转化不利
高温使反应速率加快,缩短了达到平衡所需的时间,但是对SO2的转化不利
,实际生产中采用400~500℃的温度除了考虑速率因素外,还考虑到
催化剂在该温度下活性最强,催化效果最佳
催化剂在该温度下活性最强,催化效果最佳
.
(3)增大压强对上述反应有何影响?
加快反应速率,且使平衡正向移动,有利于SO2转化和SO3的生成
加快反应速率,且使平衡正向移动,有利于SO2转化和SO3的生成
,但工业上又常采用常压进行反应,其原因是
常压时SO2的转化率已经很高,无采用高压的必要,况且,采用高压还受动力、设备等条件的限制,提高了成本
常压时SO2的转化率已经很高,无采用高压的必要,况且,采用高压还受动力、设备等条件的限制,提高了成本
.
(4)常用浓H
2SO
4而不用水吸收SO
3是由于
用水吸收SO3易形成酸雾,吸收效果差,而用浓H2SO4吸收则不易形成酸雾,吸收效果好
用水吸收SO3易形成酸雾,吸收效果差,而用浓H2SO4吸收则不易形成酸雾,吸收效果好
,尾气中SO
2必须回收,主要是为了
防止空气污染
防止空气污染
.

 53天天练系列答案
53天天练系列答案 中学化学中常见的物质有如图所示的转化关系(反应条件略去).X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸.
中学化学中常见的物质有如图所示的转化关系(反应条件略去).X、Y、Z、W是单质,其余均为化合物,A、W、Z常温下呈气态,且A是一种大气污染物,B是一种常用的酸.



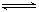 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2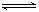 2Fe2O3的平衡常数K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数K2,则反应3CO+Fe2O3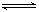 2Fe+3CO2的平衡常数K与K1、K2的关系式
2Fe+3CO2的平衡常数K与K1、K2的关系式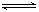 HSO3-+OH-
HSO3-+OH-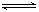 HSO3-+OH-
HSO3-+OH-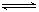 2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是
2AlCl3(g)+3CO(g)△H>0,欲提高金属铝的氯化效果,不可采取的措施是