
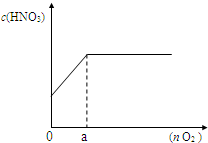
 (2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).
(2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).| 40n |
| 3 |
| 40n |
| 3 |
| m |
| M |
| V |
| Vm |
| n |
| V |
| n |
| V |
| n |
| V |
| 20g-3.2g |
| 56g/mol |
| 8.96L |
| 22.4L/mol |
|
| 1mol |
| 0.5L |
| 0.3mol×2 |
| 4 |
| 8 |
| 3 |
| 6 |
| 3 |
| 2 |
| 3 |
| 0.36mol |
| 0.1L |
| 0.4mol |
| 0.1L |
| 8 |
| 3 |
| 8n |
| 3 |
| 6 |
| 3 |
| 2 |
| 3 |
| 4n |
| 3 |
| 8n |
| 3 |
| 4n |
| 3 |
| 4n |
| 3 |
(0.2+
| ||
| 0.1L |
| 40n |
| 3 |
| 40n |
| 3 |


科目:高中化学 来源: 题型:
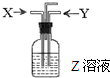 (2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )
(2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com