
化合物H是合成药物盐酸沙格雷酯的重要中间体,其结构简式如图所示(未表示出其空间构型)。下列关于化合物H的性质描述正确的是
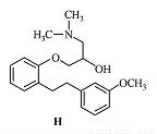
A.能与FeCl3溶液发生显色反应
B.H的分子式是C20H26NO3
C.能发生加成、取代、消去反应
D.1 mol该物质最多可与1 mol NaOH反应
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源:河北省衡水中学2012届高三第四次调研考试化学试题 题型:022
下表为元素周期表短周期的一部分
![]()
(1)H最高价氧化物对应水化物的钠盐溶液中通入少量A的最高价氧化物会发生反应,写出相应的离子方程式________;
(2)写出工业上制备H单质的化学方程式________;
(3)X、Y为同周期元素,它们简单离子的电子层结构与D离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式________.
(4)与Y同周期的W元素,其原子半径是同周期主族元素中最小的.工业上制取Y和W的无水化合物方法如下:Y的氧化物与A、W的单质在高温条件下反应,每消耗6 kg A的单质,过程中转移1×103 mol电子,写出相应反应的化学方程式________.
(5)X与B形成的化合物XB3是合成抗禽流感药物“达菲”的中间活性物质,该物质受撞击会生成一种非金属单质和一种离子化合物X3B,请写出该反应的化学方程式________
查看答案和解析>>
科目:高中化学 来源:2012届河北省衡水中学高三上学期四调考试化学试卷 题型:填空题
下表为元素周期表短周期的一部分
| | | | | |
| A | B | D | | |
| H | | | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com