
(10分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下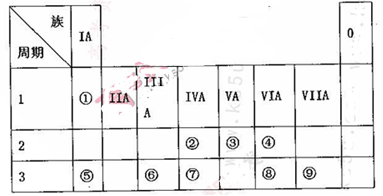
列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图____;写出它与原予半径最小的原子形成10电子且为正四面体结构的化合物的电子式____,用电子式表示⑤和⑧形成化合物的过程________。
(2).④⑤⑧形成的简单离子半径由大到小的顺序为____(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_______(填化学式)。
(3).⑤和⑨形成化合物的化学键为__________。
(4).这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是_______(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式___________________________。
(1)碳的原子结构示意图是 ;甲烷的电子式
;甲烷的电子式 ;
; ;
;
(2)S2->O2->Na+;HClO4>HNO3>H2SiO3
(3)离子键
(4)Al2O3;Al2O3+2OH-=2AlO-2+H2O
解析试题分析:(1)表中形成化合物种类最多元素是③号元素C,核电荷数是6,原子结构示意图是 ;原子半径最小的是①号H元素,C与H形成的10电子的化合物是甲烷,其电子式为
;原子半径最小的是①号H元素,C与H形成的10电子的化合物是甲烷,其电子式为 ;⑤⑧分别是Na、S元素,二者形成离子化合物Na2S,用电子式表示形成过程如下:
;⑤⑧分别是Na、S元素,二者形成离子化合物Na2S,用电子式表示形成过程如下: ;
;
(2)④⑤⑧形成的简单离子分别是O2-、Na+、S2-,S2-的电子层数最多,半径最大,O2-、Na+的电子层数相同,核电荷数越多半径越小,所以Na+的半径最小;根据元素非金属性的强弱,N、Si、Cl的最高价含氧酸的强弱顺序是HClO4>HNO3>H2SiO3
(3)⑤和⑨形成化合物是NaCl,含有离子键;
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是Al2O3;⑤的最高价氧化物对应水化物是NaOH,氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO-2+H2O。
考点:考查对元素周期表的认知,元素及其化合物的性质,元素周期律的应用


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:填空题
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a | | | |||||
| | | | b | c | d | | |
| e | | f | | | g | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素Q、R、T、W在元素周期表中的位置如下图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: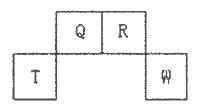
(l)W在周期表中的位置是___________,Q、R、T三种元素原予的半径从大到小排列顺序为 (用元素符号表示),Q的最高价氧化物的电子式___________,R气态氢化物分子的结构式为___________;
(2)元素的原子得电子能力:Q_____W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点___________(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是___________(填名称);
(5)现有8种属于短周期的元素,它们的性质、数据如下表所列。请指出R元素在下表中的对应编号___________,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是 ;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | | ③ | |
| 三 | | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
[物质结构与性质]
磁性材料氮化铁镍合金可用Fe(NO3)3、Ni(NO3)2、丁二酮肟、氨气、氮气、氢氧化钠、盐酸等物质在一定条件下反应制得。
(1) 基态Ni原子的价电子排布式是________。
(2) 丁二酮肟(结构简式如右图所示)中碳原子的杂化方式为________。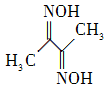
(3) NH3的沸点高于PH3,其主要原因是____。
(4) 与N3-离子具有相同电子数的三原子分子的空间构型是________。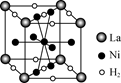
(5) 向Ni(NO3)2溶液中滴加氨水,刚开始时生成绿色Ni(OH)2沉淀,当氨水过量时,沉淀会溶解,生成[Ni(NH3)6]2+的蓝色溶液,则1 mol[Ni(NH3)6]2+含有的σ键为________mol。
(6) 右图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【选修3-物质结构与性质】(20分)
19-I(6分)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是
| A.SiX4难水解 | B.SiX4是共价化合物 |
| C.NaX易水解 | D.NaX的熔点一般高于SiX4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。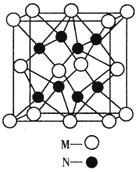
(5)该晶胞的边长为a×10 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com