
某研究小组通过实验探究金属及其化合物的性质,操作正确且能达到目的的是
A.将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色
B.向煮沸的1mol/LNaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2C03]的铜器放入盐酸中浸泡,除去铜绿
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
在恒温恒压下,a mol A和b mol B在一个容积可变的容器中发生反应:A(g)+2B(g) 2C(g),
2C(g),
一段时间后达到平衡,生成n mol C。则下列说法中正确的是
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶(a+b-0.5n)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡不移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高一上12月月考化学卷(解析版) 题型:实验题
为了验证炭粉与浓硫酸作用确实有二氧化碳气体生成,某同学创设如下图所示的A、B、C三个装置进行实验,其中省略了课本上炭粉与浓硫酸反应的发生装置图。已知C中的KMnO4酸性溶液是足量的,具有强氧化性,还原性的SO2气体经过KMnO4酸性溶液后能全部被吸收氧化,据此,请回答下列问题。
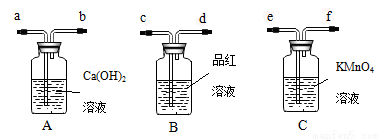
(1)炭粉与浓硫酸在加热条件下反应的化学方程式为_____________________
(2)由(1)产生的混合气体流经装置A、B、C的先后顺序是______、______、______(填A、B、C),气流依次经过装置管口顺序号为(填管口序号a、b、c、d、e、f);气体发生装置导管口接______,然后______接_____,______接_____;
(3)装置B的作用是__________________,装置B中观察到的现象是__________________;
(4)装置A中观察到的现象是_________________,得到的结论是_________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:实验题
用50mL0. 50 mol•L-1盐酸与50mL0. 55mol•L-1NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
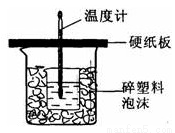
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________;
(2)烧杯间填满碎纸条的作用是________;
(3)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大、偏小、无影响”);
(4)如果用60mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、不相等”),所求中和热______(填“相等、不相等”),简述理由__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:选择题
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+3/2 O2(g)═CO2(g)+2H2O(l) △H=+725.8kJ/mol
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H=-1452kJ/mol
C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H=-725.8kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) △H=+1452kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:填空题
结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
Cu2Cl2·2CO·2H2O是一种配合物,其结构如图所示
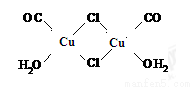
工业上制备该物质的反应如下:2CuCl+2CO+2H2O=Cu2Cl2·2CO·2H2O
(1)该配合物中金属阳离子的核外电子排布式为______________________;
(2)与CO为互为等电子体的阴离子是_______________(写一种即可)。
第二周期元素中,第一电离能介于B、N之间的元素除C外,还有_______(填元素符号)。
(3)该配合物中,氯离子的杂化方式为__________;用“ ”标出该物质中配位键。
”标出该物质中配位键。
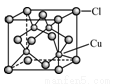
(4)CuCl的晶胞如右图所示,距离每个Cu+最近的Cl-的个数为_______。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.0.1 mol•L-1的硫酸溶液中,H+的物质的量为0.2 mol
B.0.1mol—NH2(氨基)中含有的电子数为0.7mol
C.30gSiO2中含有的Si—O键数目为2mol
D.0.1molSO2与足量O2反应,转移的电子数为0.2mol
查看答案和解析>>
科目:高中化学 来源:2016届云南师范大学附属中学高三上高考适应性月考化学试卷(解析版) 题型:填空题
铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)工业上,向炽热铁屑中通入氯化氢可生成无水氯化亚铁,若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是____________________;为防止FeCl2溶液中含有FeCl3,最好在FeCl2溶液中加入___________。
(2)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,同时伴随产生一种可燃性气体,该反应的化学方程式为___________。
若有1molC参与反应,则转移的电子数目为___________。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开,只允许锂离子通过)工作原理为FePO4+Li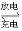 LiFePO4,如下图所示。则放电时FePO4一端为电池的_____极,充电时阳极上的电极反应式为__________________。
LiFePO4,如下图所示。则放电时FePO4一端为电池的_____极,充电时阳极上的电极反应式为__________________。
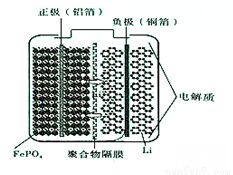
(3)硫化亚铁常用于工业废水的处理。已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)=3.6×10-29.请写出用硫化亚铁处理含Cd2+的工业废水的离子方程式__________________,在FeS、CdS的悬浊液中c(Fe2+):c(Cd2+)=______________。
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L 100mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入___________ml、2mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列依据相关实验得出的结论正确的( )
A.SiO2既能与HF溶液反应,又能与NaOH溶液反应,说明SiO2是两性氧化物
B.用大理石和浓盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中,出现白色沉淀证明H2CO3的酸性比H2SiO3的酸性强
C.向某溶液中滴加硝酸酸化的Ba(NO3)2溶液产生白色沉淀,说明该溶液中含有SO42-
D.相同体积PH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com