
分析 某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)若为CH3COONa溶液,由醋酸根离子水解来分析;
(2)该溶液是由体积相等的NaOH溶液和醋酸混合而成,且两者恰好中和,则醋酸与氢氧化钠的物质的量相等,反应生成的是醋酸钠溶液;醋酸为弱电解质,在溶液中只能部分电离,则反应前酸中c(H+)小于碱中c(OH-);
(3)要使混合溶液呈酸性,则醋酸的物质的量大于氢氧化钠;溶液恰好呈中性,则c(H+)=c(OH-),结合电荷守恒及盐的水解原理判断溶液中各离子浓度大小.
解答 解:某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,溶质可能是氢氧化钠和醋酸钠、醋酸钠、醋酸钠和醋酸;
(1)若为CH3COONa溶液,醋酸根离子水解、钠离子不水解,溶液呈碱性,则c(OH-)>c(H+)、c(Na+)>c(CH3COO-),醋酸根离子水解程度较小,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故选①,
故答案为:醋酸钠;①;
(2)若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好反应,则两溶液中醋酸和氢氧化钠的物质的量相等,两溶液体积相等,则醋酸和氢氧化钠溶液的浓度相等;由于醋酸为弱酸,氢氧化钠为强电解质,则混合前酸中c(H+)小于碱中c(OH-),
故答案为:等于;小于;
(3)要使混合溶液呈酸性,则醋酸的物质的量大于氢氧化钠,二者体积相等,则混合前两溶液的物质的量浓度大小关系为c(NaOH)<c(CH3COOH);溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知:c(CH3COO-)=c(Na+),则溶液中离子浓度大小为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-),
故答案为:小于;c(CH3COO-)=c(Na+)>c(H+)=c(OH-).
点评 本题考查离子浓度的大小比较,题目难度中等,注意根据溶液离子浓度的关系结合弱电解质的电离和盐类的水解等知识解答,溶液中电荷守恒的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
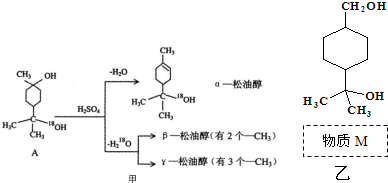
 .
.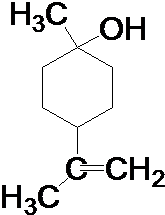 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36:60 | B. | 60:36 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 依据氧化还原反应:
依据氧化还原反应:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
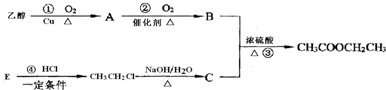
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
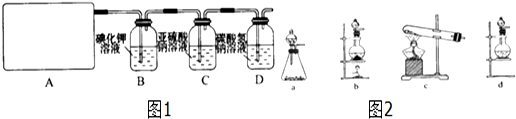
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
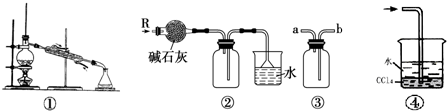
| A. | 装置①可用于由工业酒精制取无水酒精 | |
| B. | 装置②可用于干燥、收集氨气,并吸收多余的氨气 | |
| C. | 装置③可用于排空气法收集NO气体 | |
| D. | 装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,23g NO2中含有NA个O原子 | |
| B. | 16g CH4中含有NA个C-H共价键 | |
| C. | 标准状态下,2.24L水中所含的分子数为0.1NA | |
| D. | 在0.1mol/L AlCl3溶液中所含的Cl- 的个数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com