
����Ŀ�����ݸ�����Ϣ��д������ԭ����ʽ����9����
��1����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2���÷�Ӧ�����ӷ���ʽΪ ��
��2��������л�ԭ�ԣ����Ժ�������������Ӧ�������������£�H2S��KMnO4��Ӧ����S��MnSO4��K2SO4��H2O��д���÷�Ӧ�Ļ�ѧ����ʽ��
��3����ʢ��10mL1.0mol��L��1�ĵ�ˮ���Թ��У�ͨ������Cl2��ȫ��Ӧ��ת����0.1mol���ӡ�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1��4H����5ClO![]() ===Cl����4ClO2����2H2O
===Cl����4ClO2����2H2O
��2��3H2SO4��5H2S��2KMnO4===5S����2MnSO4��K2SO4��8H2O
��3��I2��5Cl2��6H2O===2HIO3��10HCl
��������
�����������1��������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2������Ԫ���غ��֪Ӧ����ˮ���ɣ��÷�Ӧ�����ӷ���ʽΪ��4H++5ClO2-=Cl-+4ClO2��+2H2O��
��2��H2S��KMnO4��Ӧ����S��MnSO4��K2SO4��H2O����Ӧ�ķ���ʽΪ3H2SO4+5H2S+2KMnO4=5S��+2MnSO4+K2SO4+8H2O��
��3��װ��B��װ��10.0mL1.0molL-1�ĵ�ˮ����ͨ������Cl2��ȫ��Ӧ��ת����0.1mol���ӣ���IԪ�������������еĻ��ϼ�Ϊ![]() =5������������ΪHIO3����������ԭΪHCl����Ӧ����ʽΪ��5Cl2+I2+6H2O=10HCl+2HIO3��
=5������������ΪHIO3����������ԭΪHCl����Ӧ����ʽΪ��5Cl2+I2+6H2O=10HCl+2HIO3��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4A��g��+3B��g��2C��g��+D��g�����ﵽƽ��ʱ������˵����ȷ���ǣ� ��
A��A��Bȫ�������C��D
B��B������Ӧ���ʺ��淴Ӧ�������
C����Ӧ�Ѿ�ֹͣ
D��A��B��C��D�������ʵ�Ũ��һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� A��B��C��X��Ϊ��ѧ��ѧ���������ʣ�һ�������£���������ͼת����ϵ�����ֲ�������ȥ��������˵���������

A����XΪCl2����C����ΪFeCl3
B����XΪKOH��Һ����A����ΪAlCl3��Һ
C����XΪO2����A����ΪH2S��NH3
D����A��B��C��Ϊ��ɫ��Ӧ�ʻ�ɫ�Ļ������X����ΪCO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���ʼ��仯�����ںܶ���������Ҫ����;��
(1)��ϸͭ�ۿ���[Cu(NH3)4]SO4�Ʊ���
�� [Cu(NH3)4]SO4�н��������ӵĺ�������Ų�ʽΪ ��N��O��S����Ԫ�صĵ�һ�����ܴ�С˳��Ϊ ��(��Ԫ�ط���)
��NH3������Nԭ�ӵ��ӻ���ʽΪ ����NH3��Ϊ�ȵ�����������ӵĻ�ѧʽΪ ��
�� SO![]() ���ӵĿռ乹��Ϊ ��
���ӵĿռ乹��Ϊ ��
(2)�Ȼ���ͭ(CuCl)��ij�Ʊ������ǣ���CuCl2��Һ��ͨ��һ����SO2���ȣ���Ӧһ��ʱ�������CuCl��ɫ������
��д�������Ʊ�CuCl�����ӷ���ʽ�� ��
��CuCl�ľ����ṹ��ͼ��ʾ������Clԭ�ӵ���λ��Ϊ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�����и���������ָ����Һ��һ���ܴ����������( )
A����ɫ������Һ����K����Cu2����NO![]() ��Cl��
��Cl��
B��0.1 mol��L��1CaCl2��Һ����Mg2����NH![]() ��CO
��CO![]() ��SO
��SO![]()
C��pH=12����Һ��Na����K����SiO![]() ��Cl��
��Cl��
D��ʹ���ȱ�����Һ����Na����Fe2����NO![]() ��Cl��
��Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/L��NH4Fe(SO4)2��Һ�У����и��������ܴ����������
A. H+��Ba2+��Br����I�� B. K+��Na+��CO32����OH��
C. Cu2+��Al3+��Cl����NO3�� D. Ca2+��Mg2+��CH3COO����SCN��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦA(g)+3B(s)![]() 2C(g)+2D(g)���ڲ�ͬ�����µĻ�ѧ��Ӧ�������£����б�ʾ�ķ�Ӧ����������
2C(g)+2D(g)���ڲ�ͬ�����µĻ�ѧ��Ӧ�������£����б�ʾ�ķ�Ӧ����������
A����(A)=0.5mol/(L��min) B����(B)=1.2mol/(L��s)
C����(C)=0.1mol/(L��s) D����(D)=0.4mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£�������������ƿ�������ſ������ռ����ǣ� ��
A��CO2 B��NO2 C��Cl2 D��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A�Ľṹ��ʽ��ͼ�������й�A��˵����ȷ����( )
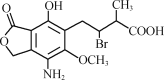
A������ʽΪC14H25O6NBr
B���÷����к�����������̼ԭ��
C������ʹ���Ը��������Һ��ɫ
D��A��һ��������������������Һ��Ӧ��1 mol A�������3 mol NaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com