
| A. | 溶液中NaOH的物质的量 | B. | 溶液中Na+的物质的量浓度 | ||
| C. | 溶液中Na+的数目 | D. | 溶液的质量 |
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
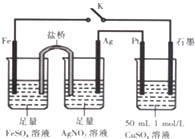
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 导线中流过0.2mol电子时,加入4.9gCu(OH)2,CuSO4溶液可恢复原组成 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 闭合K,外电路电流方向为Fe电极→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH=CH2 烯烃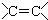 | B. | 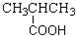 羧酸-COOH 羧酸-COOH | ||
| C. |  醛类 醛类 | D. | RCH2OH (R为烃基) 醇类-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,通过电解原理来降解酸性废水中的NO3-,下列说法错误的是( )
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,通过电解原理来降解酸性废水中的NO3-,下列说法错误的是( )| A. | 该新型电池工作时,负极的电极反应式是Al+4OH--3e-═AlO2-+2H2O | |
| B. | 为增强溶液的导电性,I区水中可加入少量Na2SO4 | |
| C. | A为电源正极,H+从Ⅰ区移向Ⅱ区 | |
| D. | 阴极反应式为:2NO3-+6H2O+10e-═N2↑+12OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com