
 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”.制备原理如下:| 化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 436 | 343 | 465 | 453 | 413 |
分析 (1)根据盖斯定律:由①CH4(g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-890.3kJ/mol、②CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1453.0 kJ•mol-1和③H2O(l)=H2O(g)△H=+44.0kJ/mol可计算出△H1;又根据反应的焓变=反应物总键能-生成物总键能计算出△H3;
(2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;根据勒夏特列原理分析;反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度、含量等不再发生变化,以及由此衍生的其它量不变,可由此进行判断;
(3)按平衡的三段式可求出用H2表示反应②的速率和可逆反应③的平衡常数K3;再求出浓度商跟平衡常数比较可分析出反应③v(正)与v(逆)的大小.
解答 解:(1)甲烷燃烧的热化学方程式为:①CH4(g)+2O2 (g)═CO2 (g)+2H2O(l)△H=-890.3kJ/mol;
二甲醚燃烧的热化学方程式为:②CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H=-1453.0 kJ•mol-1;
③H2O(l)=H2O(g)△H=+44.0kJ/mol;
对应反应2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=①×2-②+③=-890.3kJ/mol×2+1453.0kJ/mol+44.0kJ/mol=-283.6kJ•mol-1;
反应的焓变=反应物总键能-生成物总键能,而反应2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3=2×(3×413kJ/mol+343kJ/mol+453kJ/mol)-6×413kJ/mol-2×343kJ/mol-2×465kJ/mol=-24kJ/mol;
故答案为:-283.6kJ•mol-1;-24kJ•mol-1;
(2)该反应的化学平衡常数表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;
升温,反应①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=-283.6kJ•mol-1,向逆反应方向移动,能正确反映反应①中CH4的体积分数随温度变化的曲线是b;
表明反应①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)达到化学平衡状态的
a.混合气体的密度始终不变,故a错误;
b.反应容器中二甲醚的百分含量不变,表明达到平衡,故b正确;
c.反应物的反应速率与生成物的反应速率之比始终等于化学计量数之比;故c错误;
d.混合气体的压强不变,表明达到平衡,故d正确.
故答案为:$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;b;bd;
(3)CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 1 3 0
转化量(mol/L) 0.8 1.6 0.8
平衡量(mol/L) 0.2 1.4 0.8
v(H2)=$\frac{1.6mol/L}{8min}$=0.2mol/(L•min);
2CH3OH(g)?CH3OCH3(g)+H2O(g)
起始量(mol/L) 0.8 0 0
转化量(mol/L) 0.6 0.3 0.3
平衡量(mol/L) 0.2 0.3 0.3
k=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.3×0.3}{0.{2}^{2}}$=2.25;
若在500K时,容器中n(CH3OH)=n(CH3OCH3)时,设c(CH3OH)=xmol/L,则
2CH3OH(g)?CH3OCH3(g)+H2O(g)
在500K时,容器中(mol/L) x x x
浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆)
故答案为:0.2mol/(L•min);2.25;>;浓度商Q=$\frac{c(C{H}_{3}OC{H}_{3})•c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{x•x}{{x}^{2}}$=1<2.25,反应正向进行,v(正)>v(逆).
点评 本题考查较为综合,涉及反应热与焓变、化学平衡状态的判断等知识,题目难度中等,明确化学平衡状态的特征为解答关键,注意掌握反应热与焓变的关系及应用方法,试题培养了学生的分析能力及灵活应用能力.


 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 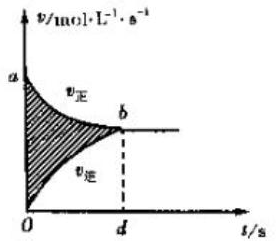 图阴影部分面积表示反应物浓度的净减少量M | |
| B. | 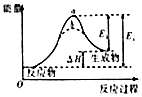 图虚线b表示反应加入催化剂后能量变化曲线 | |
| C. | 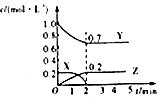 图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)?2Z(g) | |
| D. |  图对应于反应H2(g)+CO2(g)?H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的$\frac{2}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
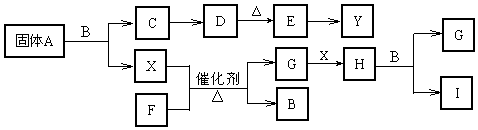
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
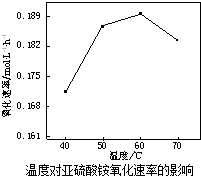 利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下:
利用氨水吸收烟气中的二氧化硫,其相关反应的主要热化学方程式如下: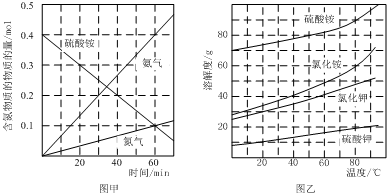
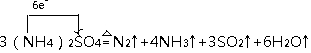 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
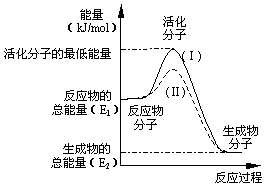 请认真观察图并利用所学的活化能的知识,回答下列问题:
请认真观察图并利用所学的活化能的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和醇发生的反应一定是酯化反应 | |
| B. | 由乙烯生成乙醇属于还原反应 | |
| C. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com