
| A. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: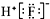 | |
| D. | 35Cl-和37Cl-离子结构示意图均可以表示为: |
分析 A.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
B.次氯酸分子的中心原子为O原子,其分子中不存在H-Cl键;
C.氟化氢为共价化合物,分子中不存在阴阳离子;
D.35Cl-和37Cl-离子的核电荷数都是17,核外电子总数都是18,其离子结构示意图相同.
解答 解:A.质子数为92、中子数为146的U原子的质量数为238,该原子正确的表示方法为:23892U,故A错误;
B.次氯酸分子中含有1个H-O键和1个O-H键,其正确的结构式为:H-O-Cl,故B错误;
C.氟化氢属于共价化合物,电子式中不能标出所带电荷,其正确的电子式为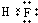 ,故C错误;
,故C错误;
D.35Cl-和37Cl-离子都是氯离子,其离子结构示意图均可以表示为: ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法判断,题目难度中等,涉及离子结构示意图、电子式、元素符号、结构式等知识,明确常见化学用语的概念及书写原则为解答关键,试题培养了学生的规范答题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若有16 g Br2生成,则反应过程中转移了0.2 mol电子 | |
| B. | Cl2是氧化剂 | |
| C. | NaBr发生了还原反应 | |
| D. | NaCl为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:| X | Y | Z | W | |
| A | NaOH | Na2CO3 | NaHCO3 | CO2 |
| B | O2 | CO2 | CO | C |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).玻璃管内的电解液为NaCl溶液,通电后,溶液中产生白色沉淀,且较长时间不变色.回答下列问题:
某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).玻璃管内的电解液为NaCl溶液,通电后,溶液中产生白色沉淀,且较长时间不变色.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 改变条件 | 平衡移动方向 | n(H+) | c(H+) | c(CH3COO-) |
| 加入少量的醋酸钠固体 | ||||
| 加入镁条 | ||||
| 加入一定量水稀释 | ||||
| 加入一定量水稀释 | ||||
| 加入浓盐酸 | ||||
| 加入NaOH 固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com