
Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O。
(1) 写出反应的化学方程式:_______________________________________;
(2) 上述反应中,当生成1.8 mol Fe3+时,放出NO的体积(标准状况下)是__________L,消耗的HNO3是__________mol;
(3) 上述反应中,当有21 mol电子发生转移时,生成H3PO4是_________mol, 被还原的HNO3是___________g。
(1) 3Fe3P+41HNO3(稀)=9Fe(N03)3+14NO↑+3H3PO4+16H2O;
(2) 62..72;8.2; (3)1.5;441
【解析】(1)根据反应物和生成物可知, Fe3P失去14个电子。硝酸当还原产物是NO,硝酸得到3个电子,所以氧化剂和还原剂的物质的量之比是14︰3,因此反应式为3Fe3P+41HNO3(稀)=9Fe(N03)3+14NO↑+3H3PO4+16H2O。
(2)根据方程式可知,当生成1.8 mol Fe3+时,生成NO是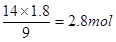 ,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是
,其标准状况下的体积是2.8mol×22.4L/mol=62.72L。消耗硝酸是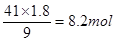 。
。
(3)根据方程式可知,当转移42mol电子时,生成磷酸时3mol,所以当有21 mol电子发生转移时,生成H3PO4是1.5mol。被还原的硝酸是7mol,质量是7mol×63g/mol=441g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:物理教研室 题型:022
(1)若用稀H2SO4或盐酸溶解样品,分析结果会________(偏高、偏低或正常),此时生铁中的磷会转化为______,请将这种产物与H2、NH3、H2O三种物质按它们的沸点由低到高顺序排列_________。
(2)若用6mol×L-1的稀硝酸溶解该生铁样品,Fe3P与稀HNO3反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:022
生铁中常含有少量磷(以Fe3P的形式存在),使生铁可铸而不可锻。欲测定生铁的含磷量,按照中国化学工业部颁布的标准分析方法,需用HNO3溶解样品。
(1)若用稀H2SO4或盐酸溶解样品,分析结果会________(偏高、偏低或正常),此时生铁中的磷会转化为______,请将这种产物与H2、NH3、H2O三种物质按它们的沸点由低到高顺序排列_________。
(2)若用6mol×L-1的稀硝酸溶解该生铁样品,Fe3P与稀HNO3反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年黑龙江省鹤岗一中高二下学期期末考试化学试卷(带解析) 题型:问答题
Fe3P与稀HNO3反应生成Fe(NO3)3、NO、H3PO4和H2O。
(1) 写出反应的化学方程式:_______________________________________;
(2) 上述反应中,当生成1.8 mol Fe3+时,放出NO的体积(标准状况下)是__________L,消耗的HNO3是__________mol;
(3) 上述反应中,当有21 mol电子发生转移时,生成H3PO4是_________mol,被还原的HNO3是___________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com