
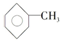
 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C->D2->A+>B2+ | B. | B2+>A+>C->D2- | C. | B2+>A+>D2->C- | D. | D2->C->A+>B2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
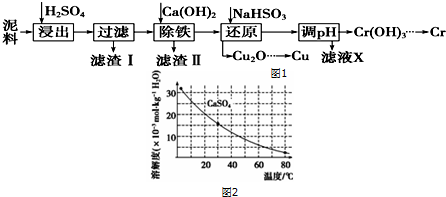
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5g | B. | 13.2g | C. | 19.7g | D. | 24.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl | B. | CHCl3 | C. | CCl4 | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别NaAlO2溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
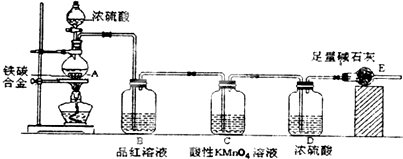
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com