
 ,Na有3层电子,最外层1个电子,失去最外层1个电子后达到8个电子的稳定结构,故钠离子结构示意图为:
,Na有3层电子,最外层1个电子,失去最外层1个电子后达到8个电子的稳定结构,故钠离子结构示意图为: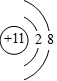 ,故答案为:
,故答案为: ;
;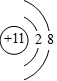 ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
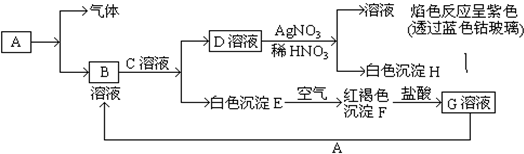
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:
A、B、C、D、E是周期表中原子序数依次增大的前20号主族元素,其中A、D同族. A是周期表中电负性最大的元素,金属元素B、C最高价氧化物对应的水化物能反应生成盐和水,E元素以骨盐形式存在于骨骼和牙齿中.根据信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在侯氏制碱工业中,向饱和氯化钠溶液中先通二氧化碳,后通氨气 |
| B、在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率 |
| C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室 |
| D、工业上采用电解熔融氯化铝的方法制取金属铝 |
| E、石油裂化属于化学变化,主要目的是为了获得短链不饱和气态烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、8:5 |
| C、5:8 | D、5:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com