
| A.氯化铯晶体中,每1个Cs+与其他8个Cs+等距离紧邻 |
| B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子 |
| C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
| D.PCl3和了BCl3分子中所有原子的最外层都达到8电子稳定结构 |
 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源:不详 题型:填空题
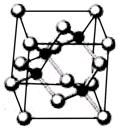
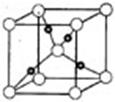
| A.砷化镓晶胞结构与NaCl相同 | B.第一电离能 As>Ga |
| C.电负性 As>Ga | D.原子半径 As>Ga |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.氙的含量比较丰富 | B.氙的相对原子质量大 |
| C.氙原子半径大,电离能小 | D.氙原子半径小,电负性大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
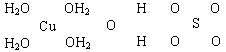
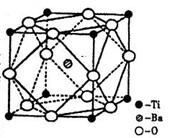
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/ kJ·mol-1 | 3791 | 3410 | 3223 | 3054 |
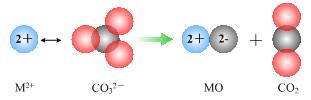
 NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。
NH4++OH-,当氨水冷却时,可以将NH3·H2O和2NH3·H2O等晶体沉淀出来。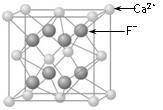
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键数目为 。
键数目为 。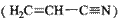 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。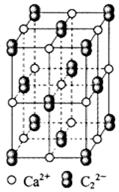
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com