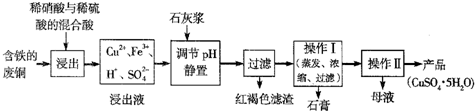
某兴趣小组在实验室用铜和硫酸为原料多种方法制取硫酸铜.制备方法如下:
方法一:
(1)浓硫酸试剂瓶上适合贴上的标签是
BD
BD
(填“序号”).

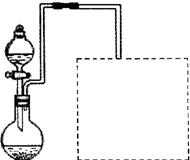
(2)甲同学取6.4g铜片和10mL l8mol?L
-1浓硫酸,放在试管中共热时发现,铜与热的浓硫酸反应后并没有得到预期的蓝色溶液,而是在试管底部看到灰白色沉淀.甲同学为了验证其中白色沉淀的主要成分.设计下列实验:
实验步骤:倾倒掉上层液体后,向所得灰白色的固体中加入适量蒸馏水,边加边搅拌.
实验现象
沉淀中白色物质溶解,溶液变蓝色
沉淀中白色物质溶解,溶液变蓝色
;
实验结论:所得白色固体的化学式为
CuSO4
CuSO4
.
(3)乙还观察到加热过程中,起初液面以下出现大量白色烟雾,在试管内壁上部析出少量淡黄色固体物质,持续加热,淡黄色固体物质又慢慢地溶于浓硫酸面消失.淡黄色固体消失的原因是(用化学反应方程式回答)
S+2H2SO4(浓)═3SO2↑+2H2O
S+2H2SO4(浓)═3SO2↑+2H2O
.直到最后反应完毕,发现试管中还有铜片剩余.乙根据自己所学的化学知识,认为试管中还有硫酸剩余.他这样认为的理由是
随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应
随着反应的进行,浓硫酸的浓度逐渐变小,由浓变稀,稀硫酸不能与铜发生反应
.
方法二:
(4)丙同学认为甲设计的实验方案不好,他自己设计的思路是:2Cu+O
22CuO,Cu+H
2SO
4═CuSO
4+H
2O.对比甲的方案,你认为丙同学的优点是:
①
产生等量的硫酸铜消耗的硫酸更少
产生等量的硫酸铜消耗的硫酸更少
,
②
不产生污染物SO2
不产生污染物SO2
.




 名校课堂系列答案
名校课堂系列答案