
| A. | 缩小体积使压强增大 | B. | 体积不变充入稀有气体使压强增大 | ||
| C. | 体积不变充入He使压强增大 | D. | 压强不变充入稀有气体氖 |
分析 决定化学反应速率快慢的因素有内因和外因,反应物本身的性质(内因),温度、浓度、压强、催化剂等为影响化学反应速率的外界因素,对于反应N2+O2?2NO是一个反应前后体积不变的反应,据此结合选项的内容解答.
解答 解:A、缩小体积使压强增大,反应速率加快,故A正确;
B、体积不变充入稀有使压强增大,但对于反应N2+O2?2NO,充入稀有不参加反应的物质的浓度不变,活化分子的数目不变,反应速率不变,故B错误;
C、体积不变充入He使压强增大,但对于反应N2+O2?2NO,充入He参加反应的物质的浓度不变,活化分子的数目不变,反应速率不变,故C错误;
D、压强不变充入稀有气体氖,体积变大,各组分的浓度变小,反应速率减慢,故D错误;
故选A.
点评 本题考查影响化学反应速率的外界因素的适用范围,明确温度、压强、浓度、催化剂等常见的对反应的影响因素是解答的关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的柔软金属,密度都比水小 | |
| B. | 单质在空气中燃烧生成的都是过氧化物 | |
| C. | 碱金属单质都能与盐酸反应放出氢气 | |
| D. | 单质的熔、沸点随着原子序数的增加而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
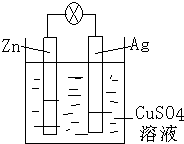 如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题:
如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通常用单位时间内反应物或生成物的质量变化来表示 | |
| B. | 用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于反应方程式中对应物质的化学计量数之比 | |
| C. | 反应速率越大,则单位时间内生成物的产量就越大 | |
| D. | 在反应过程中,反应物浓度逐渐变小,所以用反应物表示的化学反应速率为负值 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 次数 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 50 | 50 |
| 剩余固体的质量/g | 2.6 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
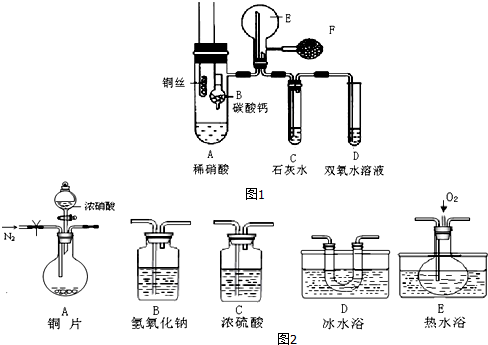
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com