
某盐溶液中可能含有NH4+、Ba2+、Na+、Fe2+、Cl—、CO32—、NO3—七种离子中的数种。某同学取4份此溶液样品,分别进行了如下实验:(硝酸具有强氧化性,可以氧化Fe2+、I-、S2-、SO32—等等)
①用pH试纸测得溶液呈强酸性;
②加入 过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
③加入硝酸酸化的AgNO3溶液产生白色沉淀;
④加足量BaCl2溶液,没有沉淀产生,在溶液中加入氯水,再滴加KSCN溶液,显红色
该同学最终确定在上述七种离子中肯定含有NH4+、Fe2+、Cl—三种离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
A.①②④ B.①② C.①②③④ D.②③④
(1)(3分)食品和药品关系人的生存和健康。
①市场上销售的食盐品种很多。下列食盐中,所添加的元素不属于人体必需微量元素的是 (填字母)。
A.加锌盐 B.加碘盐 C.加钙盐
②纤维素被称为“第七营养素”。食物中的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排出有害物质。从化学成分看,纤维素是一种 (填字母)。
A.多糖 B.蛋白质 C.脂肪
③某同学感冒发烧,他可服用下列哪种药品进行治疗 (填字母)。
A.麻黄碱 B.阿司匹林 C.抗酸药
(2)(5分)材料是人类赖以生存和发展的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同的主要原料是 。
②生活中有大量的铝制品。 家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示) 。
③有机玻璃受热时会软化, 易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为
易于加工成型。有机玻璃是一种 材料(选填“硅酸盐”或“纤维”或“塑料”)。导电塑料的结构可表示为 ,则其单体的结构简式为 。
,则其单体的结构简式为 。
(3)(7分)保护环境、保护地球是人类共同的呼声。
①向煤中加入石灰石作为脱硫剂,可以减少煤燃烧时产生的SO2。发生反应的化学方程式为 。
②天然水中含有的细小悬浮颗粒可以用 做混凝剂(写名称)进行净化处理。工业废水中含有的Cr3+离子,可用熟石灰作沉淀剂,在pH为8~9时生成沉淀而除去,该反应的离子方程式是 。
③城市餐饮业会产生大量污染环境的“地沟油”。“地沟油”的主要成分是油脂。综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取甘油和 。生活中会产生大量废弃塑料,将废弃塑料进行 处理,可以获得乙烯、丙烯等化工原料。
科目:高中化学 来源: 题型:阅读理解
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如图 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
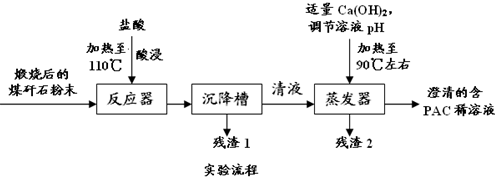
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)某无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42—等离子中的几种离子。
①经实验可知溶液明显呈酸性,且焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。
(1)该溶液中一定不含有 (填离子的化学式)离子,一定含有的离子有 (填离子的化学式);
(2)在这些不存在的离子中,有一种离子在酸性环境中和碱性环境中都不能存在,试写出该离子与酸反应的离子方程式: ;
(3)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:
 |
①该溶液中焰色反应呈现紫色的离子的物质的量为: mol,
②写出n(Na2O2)=0.2mol时反应的总离子方程式: ;
(4)将0.1mol明矾晶体与等物质的量的某无水盐晶体X混合后溶解于水中,所得溶液与上述溶液所含离子种类完全相同。若向该溶液中加入Ba(OH)2溶液,所得沉淀的物质的量与所加入Ba(OH)2的物质的量的关系如图Ⅱ:
 |
试根据图像推断①X的化学式: ,②图像中A点溶液中的离子成分和物质的量分别是: ;
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第10讲 非金属及其化合物练习卷(解析版) 题型:填空题
大气中硫、氮的氧化物是形成酸雨的主要物质。某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等。某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成三份,进行如下实验:
试样 | 所加试剂 | 实验现象 |
第一份试液 | 滴加适量的淀粉?KI溶液 | 溶液呈蓝色 |
第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀产生 |
第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体的物质的量(n)的关系如右图 |
|
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是______________,不能确定的离子有________________。
(2)写出第一份试液滴加淀粉?KI溶液时发生反应的离子方程式:__________________。
(3)第三份试液滴加NaOH溶液,加热,整个过程中发生了多个反应,写出其中两个反应的离子方程式:__________________________________、__________________________。
(4)设计实验方案,检验该酸雨中是否存在Cl-:___________________________________
______________________________。
(5)该小组为了探究NO参与硫酸型酸雨的形成过程,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com