
【题目】(1)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、
②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1 硝酸银溶液中,
其中Ag+浓度最小的是____________。(填序号)
(2)电解氯化钠可以得到多种化工原料。用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO![]() 等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO
等杂质。某次除杂操作时,往粗盐水中先加入过量的BaCl2溶液,至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO![]() ,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
,其原因是______________________________[已知:Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=2.6×10-9]。
【答案】 ③ BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO![]() 时,BaSO4(s)会部分转化为BaCO3(s)
时,BaSO4(s)会部分转化为BaCO3(s)
【解析】试题分析:(1)氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,氯离子浓度越大、银离子浓度越小;(2)BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO![]() 时,BaSO4(s)会部分转化为BaCO3(s)
时,BaSO4(s)会部分转化为BaCO3(s)
解析:(1)①蒸馏水中含银离子浓度和氯离子浓度相同;②0.1 mol/L盐酸溶液中氯离子浓度为0.1mol/L;氯离子抑制氯化银溶解,Ag+浓度减小;③0.1 mol/L MgCl2溶液中Cl-浓度为0.2mol/L,氯离子抑制氯化银溶解,Cl-浓度越大,Ag+浓度越小;④0.1mol/L硝酸银溶液中Ag+浓度为0.1mol/L;其中Ag+浓度最小的是③;(2) 往粗盐水中先加入过量的BaCl2溶液,生成硫酸钡沉淀,再加入过量的Na2CO3和NaOH,BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO![]() 时,BaSO4(s)会部分转化为BaCO3(s),所以滤液中仍含有一定量的SO
时,BaSO4(s)会部分转化为BaCO3(s),所以滤液中仍含有一定量的SO![]() 。
。
附加题


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。

(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应④ 的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然食用香料X是芳香族化合物,可以从某些植物中提取。由X合成H的路线如下:

已知:①A的核磁共振氢谱有6个峰;②H为酯类物质,结构中除苯环外还含有一个六元环;③G的产量是衡量一个国家石油化工发展水平的标志。
请回答下列问题:
(1)A的结构简式为______,检验A中非含氧官能团所用的试剂为_______。
(2)②的反应类型为____________。反应③的化学方程式为_____________。
(3)F中所含官能团的名称为____________,其同分异构体中,遇FeCl3溶液发生显色反应,且能与碳酸氢钠溶液反应,其苯环上一氯代物只有一种,符合条件的同分异构体数目为________种,写出其中一种结构简式:____________。
(4)设计一条以G为起始原料合成乙二酸的路线______________,无机物任选,注明反应条件。示例如下: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应与能量以及化学平衡原理是中学化学学习的重要内容。请回答下列问题:
⑴己知:CH4、H2的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol,则CO2和H2反应生成CH4和H2O(l)的热化学方程式是_________________________________。
⑵设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。电池正极的电极反应式是_____________,A是______________。

⑶25 ℃时,向含a mol NH4Cl的水溶液滴加b L氨水后溶液呈中性,则所滴加氨水的浓度为________mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5)
⑷甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用合成气制备甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变△H_______0 (填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填“>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是_________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质之间通过一步反应不能实现如图所示转化的是( )

选项 | a | b | c |
A | Si | SiO2 | H2SiO3 |
B | SO2 | SO3 | H2SO4 |
C | NaOH | Na2CO3 | Na2SO4 |
D | NO | NO2 | HNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

(1)用(NH4)2SO4与NH3·H2O的混合溶液浸取锌焙砂生成[Zn(NH3)4]2+的过程中加入H2O2的目的是________。
(2)加入(NH4)2S除杂过程中的主要离子方程式为________。
(3)过滤3所得滤液可循环使用,其主要成分的化学式是_______。
(4)检验2Zn(OH)2·ZnCO3沉淀是否洗涤干净的方法是________。
(5)写出沉锌步骤中发生反应的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
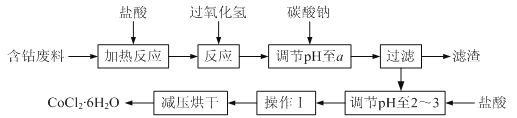
已知:①CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,易失去结晶水变成有毒的无水氯化钴。(乙醚:无色液体,沸点34.5℃,在水中的溶解度小)
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)钴的性质与铁相似,能与盐酸和硝酸反应,写出钴与盐酸反应的化学方程式:________________________________。
(2)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点:
①为__________________________,防止大气污染;
②防止产品中混有硝酸盐。
(3) 加入碳酸钠调节pH至a,a的范围应是5.2~_________。
(4) 操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和_________。
(5)根据表中数据,判断Ksp[Fe(OH)3] ________Ksp[Co(OH)2] (填“<”、“=”或“>”) 。在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是:将产品溶于乙醚过滤后,再蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3的混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如下图所示。下列判断正确的是

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为CO32- +2H+ = CO2 ↑+H2O
C. a = 0.3
D. 原混合溶液中NaOH和Na2CO3的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com