
分析 A、B、C、D四种可溶性盐,则给出八种离子形成四种可溶性盐,这个可以通过一一组合的形式确定可能存在的物质,之后结合进行实验和颜色限制进行继续排除,从而最终确定,如Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-;Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4;Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3.
解答 解:由于是可溶性盐,所以溶液中存在的盐离子和阴离子对应物质一定是可溶性,根据盐类物质溶解性情况可知:Ba2+不能和SO42-、CO32-结合,而只能和NO3-、Cl-,Ag+不能和SO42-、Cl-、CO32-三种离子结合,而只能和NO3-结合,则一定是BaCl2、AgNO3.Cu2+不能和CO32-结合,所以为CuSO4,Na+对应CO3 2-为Na2CO3.即四种物质为BaCl2、AgNO3、CuSO4、Na2CO3;由于C盐是蓝色的,所以A为CuSO4;四支试管加入盐酸,B有沉淀,则B溶液为AgNO3;D生成无色气体,则为二氧化碳,即D为Na2CO3,所以A为BaCl2,
根据分析可知,A为BaCl2,B为AgNO3,C为CuSO4,D为Na2CO3,
故答案为:BaCl2;AgNO3;CuSO4;Na2CO3.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意熟练掌握常见离子的检验方法,试题侧重基础知识的考查,有利于提高学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
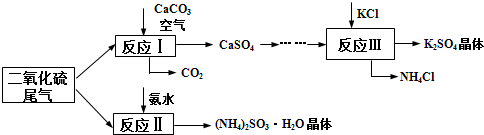
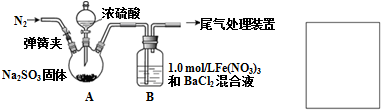
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
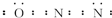 ,其分子空间构型是直线形.
,其分子空间构型是直线形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3s104sx,有+1、+2两种常见化合价 |
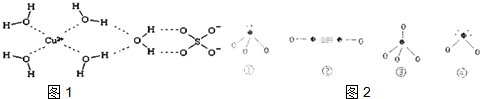
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=1溶液中:NH4+、Fe2+、NO3-、Cl- | |
| B. | 由水电离的c(H+)=10-12 mol•L-1的溶液:AlO2-、K+、CO32-、Na+ | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、CO32- | |
| D. | 所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com