
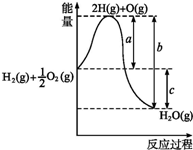
 (1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则:
(1)已知:H2(g)+1/2O2(g)═H2O(g),反应过程中能量变化如图所示,则:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| B、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大 |
| C、升高温度通过降低活化能而加快化学反应速率 |
| D、常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高纯度的硅广泛用于制作计算机 |
| B、硅可由二氧化硅还原制得 |
| C、低温时,硅与水、空气和酸不反应,但能与氢氟酸反应 |
| D、自然界中硅的储量丰富,自然界中存在大量的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、负极的反应式为CH3OH+H2O-6e-═CO2↑+6H+ |
| B、电池的反应方程式是2CH3OH+3O2═2CO2+4H2O |
| C、电池工作时,H+由正极移向负极 |
| D、电池工作时,电子从通入甲醇的一极流出,经外电路再从通入氧气的一极流入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 NaHSO3 粉末加入HNO3溶液中 |
B、 SO2气体通入新制氯水中 |
C、 NaOH溶液滴入 Ba(HCO3)2溶液中 |
D、 CO2气体通入澄清石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
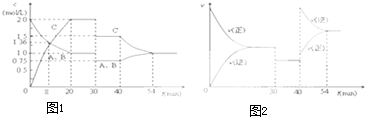
| A、第8min时 A的反应速率为0.08mol?L-1?min-1 |
| B、在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C、30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D、反应方程式中的x=1,且正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、若碳的燃烧热用△H3来表示,则△H3<△H1 |
| B、若碳的燃烧热用△H3来表示,则△H3>△H1 |
| C、浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ?mol-1 |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①O3 |
| ②Zn,H2O |
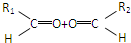
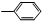 ③-CH═CH2
③-CH═CH2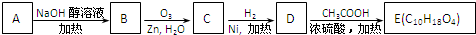
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com