
目前工业上常采用天然气制备乙炔,再由乙炔进一步制备乙酸、维尼纶等化工原料,以下是以天然气为原料的各物质间的转化关系.
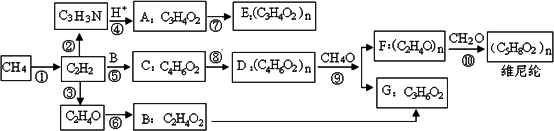
已知:R-CN+2H2O+HCl→R-COOH+NH4Cl
请填空:
(1)乙炔的电子式为________.
(2)反应②是原子利用率100%的反应,所需另一反应物的分子式为________.
(3)写出反应⑥C2H4O和新制Cu(OH)2反应的化学方程式
______________________.
(4)化合物C属于乙酸酯,且分子中含有碳碳双键,写出反应⑨的化学方程式
______________________.
(5)化合物C某种同分异构体属于酯类且含有五元环,其结构简式是________.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市朝阳区高三上学期期末考试化学试卷(解析版) 题型:简答题
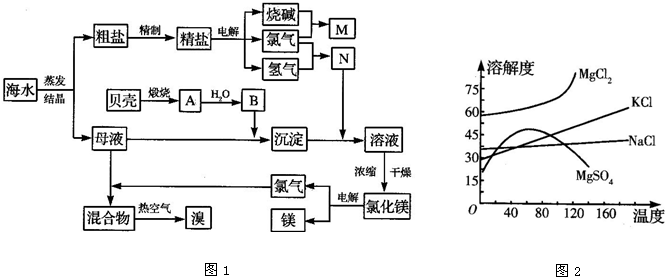
天然气(以甲烷计)在工业生产中用途广泛。
Ⅰ.在制备合成氨原料气H2 中的应用
(1)甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) 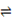 CO(g)
+ 3H2(g) ΔH = +206.2 kJ/mol
CO(g)
+ 3H2(g) ΔH = +206.2 kJ/mol
CH4(g) + 2H2O(g) 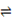 CO2(g)
+4H2(g) ΔH = +165.0kJ/mol
CO2(g)
+4H2(g) ΔH = +165.0kJ/mol
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)CO变换反应的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡变换率
(已转化的一氧化碳量与变换前一氧化碳量之比)的关系如下图所示:
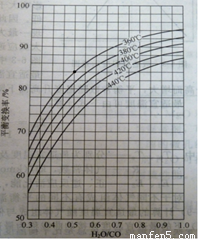
汽气比与CO平衡变换率的关系
析图可知:
① 相同温度时,CO平衡变换率与汽气比的关系是 。
② 汽气比相同时,CO平衡变换率与温度的关系是 。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),则CO变换反应的平衡常数表示式为:Kp= 。随温度的降低,该平衡常数 (填“增大”“减小”或“不变”)。
Ⅱ.在熔融碳酸盐燃料电池中的应用
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池示意图如下:
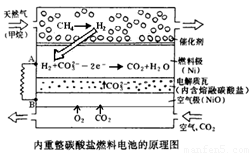
(1)外电路电子流动方向:由 流向 (填字母)。
(2)空气极发生反应的离子方程式是 。
(3)以此燃料电池为电源电解精炼铜,当电路有0.6 mol e‑ 转移,有 g 精铜析出。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省济南市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
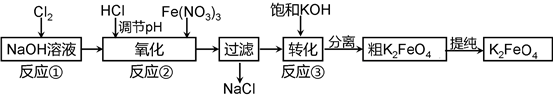
目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:

①写出反应①的离子方程式 。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是
。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是
。
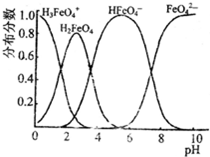
(4)FeO42—在水溶液中的存在形态图如图所示。

①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中, 转化为 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com