
��11�֣���ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ��mol-1��-283.0kJ��mol-1��-726.5kJ��mol-1����ش��������⣺
��1����̫���ֽܷ�10molˮ���ĵ�������_____________kJ��
��2���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ_____________��
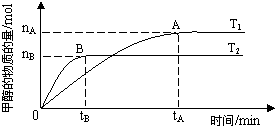
��3�����ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ��������ͼ��ʾ��ע��T1��T2������300�棩��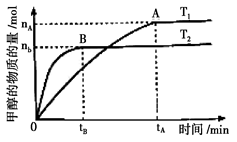
����˵����ȷ����______������ţ�
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���ƽ������Ϊ
v(CH3OH)=nA/tA mol��L-1��min-1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ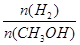 �ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2��
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2��
�ﵽƽ��ʱ����
��4����T1�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ______��
��5����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ________�������ķ�ӦʽΪ________������״̬�£���ȼ�ϵ������1mol�״����ܲ�����������Ϊ702.1KJ,���ȼ�ϵ�ص�����Ч��Ϊ________��ȼ�ϵ�ص�����Ч����ָ�������������������ȼ�ϵ�ط�Ӧ�����ͷŵ�ȫ������֮�ȣ�
��11�֣�(1) 2858
(2) CH3OH(l)+ O2(g)="CO(g)+2" H2O(l) ��H=-443.5kJ��mol-1
(3) �ۢ� (4)1-a/2
(5) CH3OH(g) +H2O-6e-= CO2 +6H+ 3/2O2 + +6H+ +6e-= 3H2O
96.6%
�����⣺��1����H2��g����ȼ���ȡ�HΪ-285.8kJ?mol-1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ��
���ֽ�1mol H2O��l��Ϊ1mol H2��g�����ĵ�����Ϊ285.8kJ����ֽ�10mol H2O��l�����ĵ�����Ϊ285.8kJ��10=2858kJ��
�ʴ�Ϊ��2858
��2����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ?mol-1��-726.5kJ?mol-1����
��3����CO��g��+1/2O2��g��=CO2��g����H=-283.0kJ?mol-1
��4����CH3OH��l��+3/2O2��g��=CO2��g��+2 H2O��l����H=-726.5kJ?mol-1
��5���ɸ�˹���ɿ�֪�â�-�ٵ÷�ӦCH3OH��l��+O2��g��=CO��g��+2 H2O��l����
��6���÷�Ӧ�ķ�Ӧ�ȡ�H=-726.5kJ?mol-1-��-283.0kJ?mol-1��=-443.5kJ?mol-1��
��7���ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2 H2O��l����H=-443.5kJ?mol-1��
��8��(3���������ͼ�������֪��T2�ȴﵽƽ����T2��T1�����¶����߷�Ӧ���������֪T2�ķ�Ӧ���ʴ���T1��
��9�����¶ȸ�ʱƽ��״̬CH3OH�����ʵ����٣���˵�����淴ӦCO2+3H2?CH3OH+H2O���淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ��
��10����T1ʱ��ƽ�ⳣ����T2ʱ�Ĵۡ�����ȷ�����и÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ���ڴ����а�����������ʵķ�����֪
��11����Ӧ���ʵĵ�λ����ӦΪmol?min-1����ٴ��ʴ�Ϊ���ۢܣ�
��4���ɻ�ѧƽ�������ģʽ�������֪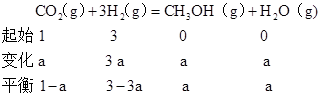
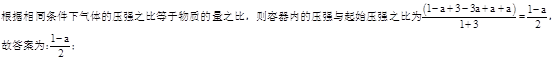



 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2011?��������ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺
��2011?��������ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1����ش��������⣺| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��| nA |
| tA |
| nA |
| tA |
| a |
| 2 |
| a |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��| nA |
| tA |
| n(H2) |
| n(CH3OH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ?mol-1��-283.0kJ?mol-1��-726.5kJ?mol-1��| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 2-a |
| 2 |
| 2-a |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ̼�ǻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʣ�
̼�ǻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʣ��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com