
| 1 |
| 8 |
| 1 |
| 4 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
 卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等.请回答下面有关问题查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省枣庄市高三3月模拟考试理综化学试卷(解析版) 题型:计算题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为________,NF3分子的空间构型为________。
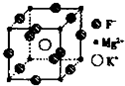
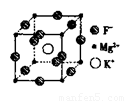
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷解析版) 题型:填空题
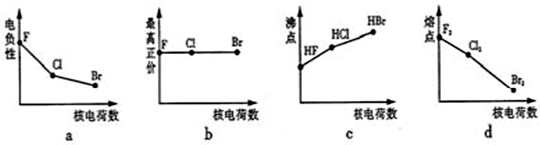
卤族元素包括F、Cl、Br等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。

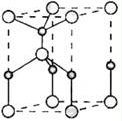
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。
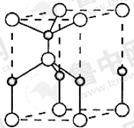
(3)BCl3和NCl3中心原子的杂化方式分别为 和 。第一电离能介于B、N之间的第二周期元素有 种。
(4)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com