
【题目】在密闭容器中,反应xA(g)+yB(g)![]() zC(g)达平衡时,A的浓度为0.5mol/L。若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
zC(g)达平衡时,A的浓度为0.5mol/L。若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
A.x+y<zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数增大
【答案】C
【解析】
保持温度不变,将容器的容积扩大到原来的2倍,若平衡不移动,则A的浓度变为0.25mol/L,由达新平衡时A的浓度降为0.3mol/L>0.25mol/L,则体积增大,压强减小,平衡向逆反应方向移动,以此来解答。
保持温度不变,将容器的容积扩大到原来的2倍,若平衡不移动,则A的浓度变为0.25mol/L,由达到新平衡时A的浓度降为0.3mol/L>0.25mol/L,则体积增大,压强减小,平衡向逆反应方向移动。
A.体积增大,压强减小,平衡向逆反应方向移动,逆反应为气体体积增大的反应,所以x+y>z,A错误;
B.由上述分析可知,化学平衡向逆反应方向移动,B错误;
C.化学平衡向逆反应方向移动,B的转化率降低,C正确;
D.化学平衡向逆反应方向移动,C的物质的量减小,混合气体总的物质的量增大,C的体积分数降低,D错误;
故含量选项是C。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】常温下,用石墨电极电解100mL、0.1molL-1NH4Cl溶液,电解过程中溶液体积变化忽略不计,溶液的pH随阳极产生气体体积(标准状况下)变化的曲线如图,下列说法正确的是( )
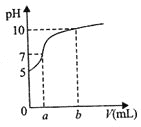
A.溶液pH=5时,c(NH3H2O)=1.0×10-5molL-1
B.电解过程使NH4+的水解程度减小,pH增大
C.若b=56mL,c(NH4+)≈5.01×10-2molL-1
D.若将阳极产生的bmL气体重新通回溶液,c(NH4+)不会改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+O2(g)![]() 2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )

A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.![]() 的体积分数:
的体积分数:![]()
D.容器I和容器II中![]() 的体积分数相同
的体积分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2))是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。某课题组以惰性电极电解盐酸和NH4Cl的混合溶液获得NCl3溶液,再以NCl3溶液和NaClO2反应制得ClO2。回答下列问题:
(1)ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示:
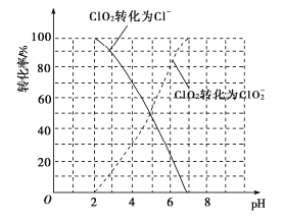
①pH≤2时,ClO2与I-反应生成I2的离子方程式为_________________。
②在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+,ClO2氧化Mn2+生成MnO2的反应中,氧化剂和还原剂的物质的量之比为________。
(2)NCl3的水解产物有NHCl2、NH2Cl等。
①NCl3的电子式为________,其中氯元素的化合价是________;NH2Cl仍可缓慢发生水解,其化学方程式为_________________。
②NCl3在NaOH溶液中水解生成N2,NaClO和NaCl,其化学方程式为______________。
③NCl3与NaClO2按物质的量之比1∶6混合,在溶液中恰好反应生成ClO2和氨,该反应的离子方程式为___________________。
(3)有下列两种方法制备ClO2:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是_______________。
(4)电解获得NCl3溶液的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )

A.T1>T2,P1>P2,m+n>x,Q>0B.T1<T2,P1<P2,m+n<x,Q>0
C.T1>T2,P1<P2,m+n<x,Q<0D.T1<T2,P1<P2,m+n>x,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓是一种广泛用于电子和通信领域的重要金属,其化学性质与铝相似。
(1)工业上提纯镓的方法有很多,其中以电解精炼法为主。具体原理如下:以待提纯的粗镓(含有Zn、Fe、Cu杂质)为阳极,以高纯镓为阴极,以NaOH水溶液为电解质溶液。在电流作用下使粗镓在阳极溶解进入电解质溶液,通过某种离子迁移技术到达阴极并在阴极放电析出高纯镓。
①已知离子的氧化性顺序为Zn2+<Ga3+<Fe2+<Cu2+电解精炼镓时阳极泥的成分为________。
②GaO2— 在阴极放电的电极反应式为______。
(2)工业上利用固态Ga与NH3在高温条件下合成固态半导体材料氮化镓(GaN),同时有氢气生成。反应过程中每生成3 mol H2,放出30.8 kJ的热量。
①该反应的热化学方程式为______。
②一定条件下,一定量的Ga与NH3进行上述反应,下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是______(填字母)。
A. 恒温恒压下,混合气体的密度不变
B. 断裂3 mol H—H键,同时断裂2 mol N—H键
C. 恒温恒压下,反应达到平衡时,向反应体系中加入 2 mol H2,NH3的消耗速率等于原平衡时NH3的消耗速率
D. 恒温恒容下, NH3 与H2的物质的量浓度之比为2︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为______(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺序为________。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,温度升高,Ka将______(填“变大”、“不变”或“变小”,下同),加入少量CH3COONa后c(H+) _________,Ka________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH—(aq)
Mg2+(aq)+2OH—(aq)
B.NaHS溶液中存在电离平衡:HS—+H2O![]() H2S+OH-
H2S+OH-
C.NaHCO3溶液中存在水解平衡:HCO3—+H2O![]() OH—+H2CO3
OH—+H2CO3
D.反应:Cr2O72—+ H2O![]() 2CrO42—+2H+,其平衡常数K=
2CrO42—+2H+,其平衡常数K=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是

A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com