55g铁、铝混合物与足量的盐酸反应,生成标准状况下的氢气44.8L,则混合物中铁和铝的物质的量之比为( )
A.1:1
B.1:2
C.2:1
D.1:3
【答案】
分析:铁、铝混合物与足量的盐酸反应,方程式分别为:Fe+2HCl=FeCl
2+H
2↑,2Al+6HCl=2AlCl
3+3H
2↑,根据质量和生成氢气的体积列方程组计算.
解答:解:n(H
2)=

=2mol.
设混合物中含有Fexmol,Alymol,
已知反应:Fe+2HCl=FeCl
2+H
2↑,2Al+6HCl=2AlCl
3+3H
2↑,则
Fe+2HCl=FeCl
2+H
2↑
x x
2Al+6HCl=2AlCl
3+3H
2↑
y

y
则有
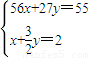
解之得:
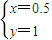
,
所以n(Fe):n(Al)=0.5:1=1:2,
故选B.
点评:本题考查混合物的计算,题目难度不大,本题注意根据反应的化学方程式结合固体的质量和生成氢气的体积列方程组计算即可解答,题目较为基础,但很典型.

 =2mol.
=2mol. y
y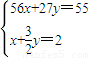
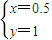 ,
,

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案