
 KIO3+3H2↑,下列说法正确的是( )
KIO3+3H2↑,下列说法正确的是( )| A.电解时,石墨做阴极,铁做阳极 |
| B.电解时,在阳极产生氢气 |
| C.电解后得KIO3产品的步骤有:过滤→浓缩→结晶→灼烧 |
| D.电解中,每转移0.6 mol电子,理论可得0.1 mol无水KIO3晶体 |
科目:高中化学 来源:不详 题型:单选题
| A.电子从大量产生气泡的一极流出 |
| B.反应一段时间后,溶液逐渐变为蓝色 |
| C.(假设溶液体积不变)烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
| D.逐渐溶解的一极上发生还原反应 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 金属 | 冶炼原理 | |||||
| A | Fe | Fe2O3+3CO
| ||||
| B | Hg | 2HgO
| ||||
| C | Mg | 2MgO(熔融)
| ||||
| D | Na | 2NaCl(熔融)
|
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 从H+、K+、Cu2+、Cl-、SO中选取适当的离子组成符合下列情况的电解质。惰性电解,电 解质的物质的量减少,水的物质的量也减少,pH下降,则电解质的化学式为( )
从H+、K+、Cu2+、Cl-、SO中选取适当的离子组成符合下列情况的电解质。惰性电解,电 解质的物质的量减少,水的物质的量也减少,pH下降,则电解质的化学式为( )| A.HCl | B.K2SO4 | C.CuSO4 | D.KCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
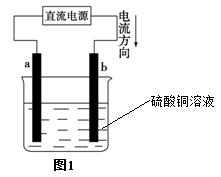
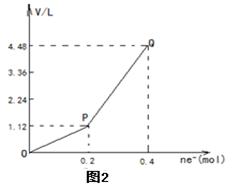
| A.电解过程中,b电极表面先有红色物质析出,然后才有气泡产生 |
| B.从开始到Q点时收集到的混合气体的平均相对分子质量为17 |
| C.曲线OP 段表示H2和O2混合气体的体积变化,曲线PQ段表示O2的体积变化 |
| D.a电极上发生反应的方程式为:2H+ + 2e- = H2↑和4OH-–4 e-=2H2O+ O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
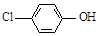 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。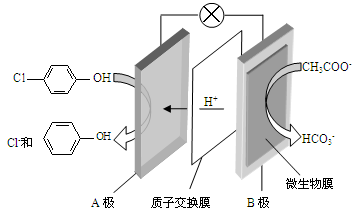
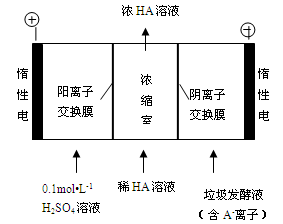
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com