解:(1)A.古人用石斧解剖,没有新物质生成,不发生化学变化,故A不选;
B.早期的农业耕作,不涉及化学变化,故B不选;
C.简单机械织布,只发生物质形变,没有新物质生成,不涉及化学变化,故C不选;
D.祥云火炬的燃烧,发生化学变化,且反应中有元素化合价变化,为氧化还原反应,故D选;
故答案为:D;
(2)①反应物为FeS、氧气、水,生成物为Fe
2(S0
4)
3和硫酸,发生反应的化学方程式为4FeS
2+15O
2+2H
2O
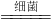
2Fe
2(S0
4)
3+2H
2S0
4,故答案为:4FeS
2+15O
2+2H
2O
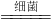
2Fe
2(S0
4)
3+2H
2S0
4;
②Cu
2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,则该离子反应为Cu
2S+10Fe
3++4H
2O
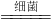
2Cu
2++10Fe
2++8H
++S0
42-,故答案为:1;10;4;2;10;8;1;
③从经济及环保的角度可知该方法的优点为对贫矿、尾矿的开采更有价值或能大大降低能源消耗,利用减少污染,故答案为:贫矿、尾矿的开采更有价值或能大大降低能源消耗,利用减少污染.
分析:(1)有元素化合价变化的反应为氧化还原反应;
(2)①反应物为FeS、氧气、水,生成物为Fe
2(S0
4)
3和硫酸;
②Cu
2S中Cu元素的化合价由+1升高为+2,S元素的化合价由-2升高为+6,Fe元素的化合价由+3价降低为+2,以此配平离子反应;
③从经济及环保的角度来分析该方法的优点.
点评:本题以信息的形式考查氧化还原反应,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大,(2)为解答的难点,注意信息与所学知识的结合来解答.

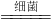 ______Cu2+______Fe2++______H++______S
______Cu2+______Fe2++______H++______S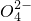
 2Fe2(S04)3+2H2S04,故答案为:4FeS2+15O2+2H2O
2Fe2(S04)3+2H2S04,故答案为:4FeS2+15O2+2H2O 2Fe2(S04)3+2H2S04;
2Fe2(S04)3+2H2S04; 2Cu2++10Fe2++8H++S042-,故答案为:1;10;4;2;10;8;1;
2Cu2++10Fe2++8H++S042-,故答案为:1;10;4;2;10;8;1;

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案