
【3分】已知某溶液中存在较多的H+、![]() 、
、![]() ,则在该溶液中不能大量存在的离子组是( )
,则在该溶液中不能大量存在的离子组是( )
①K+、![]() 、F- ②K+、Ba2+、Cl- ③Fe2+、Cl-、Br- ④K+、Na+、ClO-
、F- ②K+、Ba2+、Cl- ③Fe2+、Cl-、Br- ④K+、Na+、ClO-
A.①②③④ B.只有②③④
C.只有①③④ D.只有②③
科目:高中化学 来源: 题型:
非选择题 【共道小题,分】【14分】下图是实验室验证某铜银合金完全溶解于一定量的浓硝酸时,生成NO2气体中含有NO的实验装置。常温下,NO2与N2O4混合存在,在低于0 ℃时,几乎只有白色N2O4晶体存在。
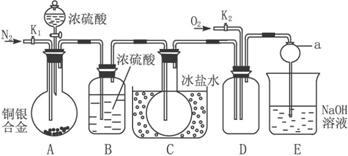
(1)反应前打开A部分的活塞K1,持续通一段时间氮气,其理由是_____________________
_____________________________________________________________________。
(2)若装置中缺B部分,其后果是__________________________________________________。
(3)反应结束后,打开D部分的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热的氧气,则瓶内气体的颜色比前者更深,其原因是__________________________。
(4)E部分中a仪器所起的作用是______________________________________________。
(5)已知该铜银合金的质量为15 g,加入40 mL 135 mol·L-1的浓硝酸,实验结束后,A部分烧瓶内溶液中的c(H+)=1 mol·L-1(假设反应中HNO3既无挥发也无分解,体积仍为40 mL)。
①参加反应硝酸的物质的量为_____________________。
②为测定铜银合金中铜的质量分数,还需要进行的主要实验操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【12分】已知A为酸式盐,B为某二价主族金属元素的化合物,C、D、F、G、I在常温常压下均呈气态,且D燃烧时产生的氧炔焰常用来焊接或切割金属。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。

(1)写出B的电子式___________,D的结构简式___________。
(2)写出A与B反应的化学方程式____________________________________。
(3)将I气体通入溶有饱和C气体的NaCl溶液,是侯氏制碱法的一步关键反应,该反应的化学方程式为___________________________________。
(4)写出下列反应的离子方程式:
①在A溶液中加入M_________________________________。
②向A溶液中加入过量NaOH溶液,并加热________________________。
③已知Fe3O4能溶于M溶液并产生F气体,该离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3) 已知:。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
的碘水进行多次取样滴定,测得
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省江南十校高三素质教育联考理科综合试卷化学部分(解析版) 题型:填空题
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为: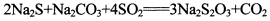 o
o
(1) 在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2) 用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应: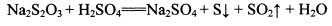
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: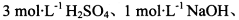 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3) 已知: 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用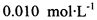 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得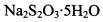 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com