
分析 (1)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到,氧化剂是化合价降低元素所在的反应物,化合价升高元素所在的反应物是还原剂;
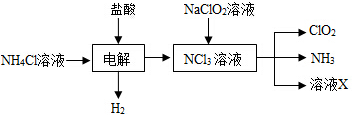
(2)(2)由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-,
①由生产流程可知氯化铵在盐酸溶液中进行电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$NCl3+3H2↑;
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-;
③由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨气为碱性气体,利用性质差异分离提纯;
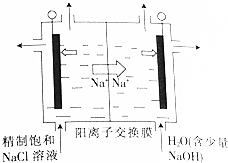
(3)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=$\frac{V}{Vm}$计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量;电解中H+浓度减小,使得H2O?OH-+H+的平衡向右移动;
③用1L NaCl溶液将0.01 mol AgBr转化为AgCl,则溶液中Br-浓度变为0.01mol/L,根据Ksp(AgBr)计算银离子的浓度,再根据Ksp(AgCl)计算c(Cl-).
解答 解:(1)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4,氧化剂是NaClO3,还原剂是C6H12O6,反应的还原剂与氧化剂的物质的量之比为1:24,故答案为:1:24;
(2)①由生产流程可知氯化铵在盐酸溶液中电解,阴极生成氢气,阳极生成NCl3,电解方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
②在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,发生NCl3+NaClO2+H2O→ClO2+NH3+NaOH+NaCl,溶液X中大量存在的阴离子有Cl-、OH-,
故答案为:Cl-、OH-;
③a.ClO2易溶于水,不能利用水吸收氨,故a错误;
b.碱石灰不能吸收氨气,故b错误;
c.浓硫酸可以吸收氨气,且不影响ClO2,故c正确;
d.ClO2易溶于水,不能利用饱和食盐水吸收氨气,故d错误;
故答案为:c;
(3)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为$\frac{0.112L}{22.4L/mol}$=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大,故答案为:0.01;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O?OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
③用1L NaCl溶液将0.01 mol AgBr转化为AgCl,则溶液中Br-浓度变为0.01mol/L,则c(Ag+)=$\frac{Ksp(AgBr)}{c(B{r}^{-})}$=$\frac{5×1{0}^{-13}}{0.01}$=5×10-11mol/L,则c(Cl-)=$\frac{1.8×1{0}^{-10}}{5×1{0}^{-11}}$=3.6 mol/L,所以c(NaCl)≥3.61 mol/L,故答案为:3.61.
点评 本题考查物质含量的测定,为高频考点,为2015年高考真题选编,把握物质的性质、制备流程、发生的反应为解答的关键,侧重分析与实验、计算能力的综合考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C3H6 | B. | C2H4 | C. | C4H6 | D. | C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定为共价化合物 | |
| B. | 含有离子键的化合物一定为离子化合物 | |
| C. | 吸热反应中,旧化学键断裂吸收能量;放热反应中,旧化学键断裂放出能量 | |
| D. | 吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与少量的NaHCO3溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 金属钠与水反应:2Na+2 H2O═2Na++2 OH-+H2↑ | |
| D. | 醋酸与氢氧化钠溶液的反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 1 mol OD-离子含有的质子、中子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁 | B. | N2 | C. | 铜 | D. | 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间的10个纵行的元素都是金属元素 | |
| C. | 非极性键也可能存在于离子化合物中 | |
| D. | 双原子分子中的共价键,可能是极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com