
| A、每个碳原子能与其它的原子(或碳原子)形成四条共价键 |
| B、大多数原子组成完全相同的分子具有不同的结构 |
| C、碳原子间可以形成单键、双键和叁键 |
| D、碳单质性质稳定 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、将金属钠保存在汽油中 |
| B、氢氟酸可保存在橡胶塞的玻璃试剂瓶中 |
| C、烧碱溶液用带磨口玻璃塞的试剂瓶保存 |
| D、水玻璃保存在橡胶塞的玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
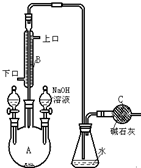 制备溴苯的实验装置如图所示,请回答下列问题:
制备溴苯的实验装置如图所示,请回答下列问题: +Br+→[
+Br+→[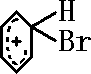 ];[
];[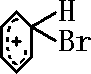 ]+FeBr4-→
]+FeBr4-→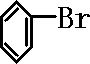 +HBr+FeBr3;
+HBr+FeBr3; +Br2→
+Br2→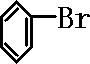 +HBr中的催化剂为
+HBr中的催化剂为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(0.1mol/L) | NH3?H2O(pH=13) | |
| HCl(0.1mol/L) | ||
| CH3COOH(0.1mol/L) | ||
| CH3COOH(pH=1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑥ | B、②③ | C、①③ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com