
【题目】分子式为C10H14的苯的同系物,其苯环上有4个甲基,符合条件的结构有:
A. 2种B. 3种C. 4种D. 5种
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,由CO和CO2组成的混合气体,相对H2的密度是20,则该混合气体CO和CO2体积比为( )
A.1:3B.1:2C.3:1D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一种固体化合物X,本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中正确的是( )
A.X一定是电解质
B.X可能是非电解质
C.X只能是盐
D.X可以是任何化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科技小组利用NaClO, NaClO2复合吸收剂研究烟气脱硫脱硝技术.
(1)随着pH值的增大,烟气脱硫和脱硝效率均呈下降趋势,可能的原因是_________。
(2)若其他条件不变,改变脱硫脱硝温度对脱除效率的影响如下图所示:
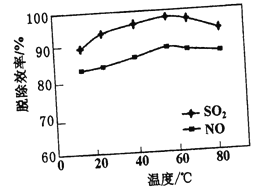
随着温度的升高,脱硫和脱硝的效率先缓慢增加,后逐渐下降,分析可能原因有____、_____。
(3)在脱硫脱硝过程中存在ClO2、ClO2-和ClO3-,它们的含量可采用连续碘量滴定法测定。已知:碘量法的瘾定反应为I2+2S2O32-=2I-+S4O62-。
实验方法:取VmL试样,控制溶液pH,加入20%的碘化钾溶液4mL,暗处放置5分钟后,用0.01mol/LNa2S2O3溶液滴定,淀粉作指示剂,记录消耗Na2S2O3溶液体积。三次实验的溶液pH、反应及消耗Na2S2O3溶液的体积见下表:
实验 | pH | 反应 | Na2S2O3溶液体积/mL |
① | pH=7.0 | 2C1O2+2I-=I2+2ClO2- | V1 |
② | pH=4.0 | ClO2-+4I-+4H+=2I2+Cl-+2H2O | V2 |
③ | pH<0.1 | ClO3-+6I-+6H+=3I2+Cl-+3H2O 2ClO2+10I-+8H+=5I2+2Cl-+4H2O ClO2-+4I-+4H+=2I2+Cl-+2H2O | V3 |
注:实验②控制pH前先鼓入氮气以除去ClO2。
计算试样中ClO3-的浓度为多少mg/L(写出计算过程,用含V1、V2、V3、V的代数式表示)_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】清华大学首创三室膜电解法制备LiOH,其工作原理如图。下列说法正确的是( )
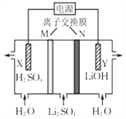
A. N为阳离子交换膜 B. X电极连接电源负极
C. 制备2.4gLiOH产生2.24LH2(标况) D. Y电极反应式为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能够鉴定卤代烃中卤元素存在的操作是 ( )
A. 在卤代烃中直接加入AgNO3溶液
B. 加蒸馏水,充分搅拌后,加入AgNO3溶液
C. 加入NaOH溶液加热后,再加入AgNO3溶液
D. 加入NaOH溶液加热后加入稀硝酸酸化,再加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。图中E为量气装置。

本实验可供选用的药品还有:稀硫酸、稀盐酸、过氧化钠、大理石、水。
试回答:
(1)图中装置的连接顺序是(填装置的字母编号),其中连接胶管及支持装置省略:_________。
(2)装置C中放入的反应物是________和_________________。(写化学式)
(3)装置A的作用是__________________;装置B的作用是_______________。
(4)装置D中发生的化学反应方程式为__________________________。
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意_____________。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质灼烧时,焰色反应为黄色,下列判断正确的是( )
A.该物质一定含钠元素,不能确定是否含有K元素
B.该物质一定是金属钠
C.该物质一定只含钠元素
D.该物质一定是钠的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com