
【题目】将0.2molL-1的的KI溶液和0.05 molL-1Fe2(SO4)3溶液等体枳混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-![]() 2 Fe2++I2的组合是
2 Fe2++I2的组合是
实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A. ①和② B. ②和③ C. ③和④ D. ①
【答案】D
【解析】
将0.2molL-1的KI溶液和0.05molL-1Fe2(SO4)3溶液等体积混合后,若此反应不可逆,Fe3+恰好完全反应,I-过量,则溶液中无Fe3+,故只需要证明溶液中含Fe3+,则即能证明此反应为可逆反应,能建立化学平衡。①向溶液中滴入KSCN溶液,溶液变红,则说明溶液中有Fe3+,即能说明反应存在平衡,故①正确;②论反应存不存在平衡,溶液中含I-,向溶液中滴入AgNO3溶液均生成黄色沉淀,不能说明反应存在平衡,故②错误;③无论反应存不存在平衡,溶液中均存在Fe2+,滴入K3[Fe(CN)6]溶液均有蓝色沉淀生成,故③错误;④无论反应存不存在平衡,溶液中均有I2,滴入淀粉溶液后溶液均变蓝色,故不能证明存在平衡,故④错误;故选D。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. FeCl3溶液可用于应急止血
B. 尿素[CO(NH2)2]可用作氮肥
C. 玻璃钢可用于制造汽车挡风破璃
D. 肥皂水可用于清洗蚊虫叮咬处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时V(正)>V(逆)
C. 25℃时反应Ni(CO)4(g)![]() Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3
Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3
D. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度2 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。右图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是

A.该装置将化学能最终转化为电能
B.a处通入O2
C.b处为电池正极,发生还原反应
D.通入O2的电极上发生的电极反应为O2 +4H+ +4e–=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A. 反应在0~3 s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B. 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH>0
C. 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%
D. 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图:

(1)步骤①反应的离子方程式是_______________________________________,
步骤③反应的化学方程式是_______________________________________。
(2)从理论上考虑,下列物质也能吸收Br2的是________________。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤③中氧化剂是____________,若反应中生成2 mol HBr,则消耗________mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本元素之一,可以sp3 、sp2和sp杂化轨道成共价键,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态碳原子核外有__________种空间运动状态的电子,其价电子排布图为 。
(2)光气的分子式为COCl2,又称碳酰氯,是一种重要的含碳化合物,判断其分子立体构型为 ,其碳原子杂化轨道类型为 杂化。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:

试解释为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?
(4)碳的一种同素异形体——C60,又名足球烯,是一种高度对称的球碳分子。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为
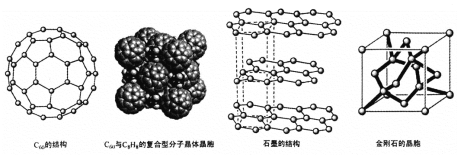
(5)碳的另一种同素异形体——石墨,其晶体结构如上图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为 个。已知石墨的密度为ρg.cm-3 ,C-C键长为rcm,阿伏伽德罗常数的值为NA,计算石墨晶体的层间距为 cm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com