
【题目】PETG是一种新型材料,可回收利用,对环境不构成任何威胁,其结构简式如下: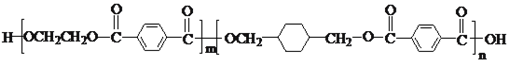 ,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:
,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:

试回答下列问题:
(1)试剂X为______________;反应⑦的反应类型为_______________。
(2)写出物质H的名称________________________。
(3)写出结构简式: I_____________________________。
(4)写出反应⑤的化学方程式:_________________________________________。
(5)合成时应控制的单体的物质的量n (D)∶n (F)∶n (H)=__________(用m、n表示)。
(6)同时符合下列要求的物质H的同分异构体共有__________种。
①遇FeCl3溶液显紫色;②能与NaHCO3溶液反应,并有气体放出;③能发生银镜反应。
(7)已知:![]() 请写出由D及其它必要物质可合成
请写出由D及其它必要物质可合成![]() 的反应历程。________________
的反应历程。________________
【答案】 NaOH溶液 取代反应 对苯二甲酸 或1,4-苯二甲酸 
 m :n :(m+n) 10种
m :n :(m+n) 10种 
【解析】本题考查有机物推断和合成综合运用,根据PETG的结构简式,推出单体为HO-CH2-CH2-OH、![]() 、
、![]() ,根据合成路线,以及B的分子式,推出D为HO-CH2-CH2-OH,E→G发生氧化反应,应是醇的氧化,即E为醇,G为醛,G→H应是继续发生氧化反应,H为羧酸,因此F为
,根据合成路线,以及B的分子式,推出D为HO-CH2-CH2-OH,E→G发生氧化反应,应是醇的氧化,即E为醇,G为醛,G→H应是继续发生氧化反应,H为羧酸,因此F为![]() ,H为
,H为![]() ,(1)根据上述分析,反应③发生卤代烃的水解,即试剂X为NaOH溶液,根据题中所给信息,RCOOR1+R2OH―→RCOOR2+R1OH,此反应应属于取代反应,即反应⑦的类型为取代反应;(2)根据H的结构简式,H的名称为对二苯甲酸或1,4-苯二甲酸;(3)根据信息,RCOOR1+R2OH―→RCOOR2+R1OH,推出I为
,(1)根据上述分析,反应③发生卤代烃的水解,即试剂X为NaOH溶液,根据题中所给信息,RCOOR1+R2OH―→RCOOR2+R1OH,此反应应属于取代反应,即反应⑦的类型为取代反应;(2)根据H的结构简式,H的名称为对二苯甲酸或1,4-苯二甲酸;(3)根据信息,RCOOR1+R2OH―→RCOOR2+R1OH,推出I为 ;(4)反应是Cu作催化剂,E与O2发生氧化反应,即醇被氧化成醛,反应方程式为:
;(4)反应是Cu作催化剂,E与O2发生氧化反应,即醇被氧化成醛,反应方程式为: ;(5)依据PETG的结构简式,D的物质的量为m,F的物质的量为n,H的物质的量为(m+n),则三者比值为m:n:(m+n);(6)遇FeCl3溶液显紫色,说明含有酚羟基,能与NaHCO3溶液反应,并有气体产生,说明含有羧基,能发生银镜反应,说明含有醛基,根据H的结构简式,以及上述分析,H中一个羧基拆写成羟基和醛基,另一个羧基不变,因此符合条件的结构简式为:
;(5)依据PETG的结构简式,D的物质的量为m,F的物质的量为n,H的物质的量为(m+n),则三者比值为m:n:(m+n);(6)遇FeCl3溶液显紫色,说明含有酚羟基,能与NaHCO3溶液反应,并有气体产生,说明含有羧基,能发生银镜反应,说明含有醛基,根据H的结构简式,以及上述分析,H中一个羧基拆写成羟基和醛基,另一个羧基不变,因此符合条件的结构简式为: (羧基在苯环上有4种位置可以取代)、
(羧基在苯环上有4种位置可以取代)、 (羧基在苯环上有4种位置可以取代)、
(羧基在苯环上有4种位置可以取代)、![]() (羧基在苯环上有2种位置可以取代),共有10种结构;(7)根据目标产物,以及题中信息,生成
(羧基在苯环上有2种位置可以取代),共有10种结构;(7)根据目标产物,以及题中信息,生成![]() ,应是OHCCH2CH(OH)CH(OH)CH2CHO发生消去反应生成,依据
,应是OHCCH2CH(OH)CH(OH)CH2CHO发生消去反应生成,依据![]() ,推出生成OHCCH2CH(OH)CH(OH)CH2CHO,应是OHC-CHO与CH3CHO发生加成反应,乙二醇氧化产生乙二醛,即路线为
,推出生成OHCCH2CH(OH)CH(OH)CH2CHO,应是OHC-CHO与CH3CHO发生加成反应,乙二醇氧化产生乙二醛,即路线为 。
。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________。
(3)E的最高价氧化物分子的空间构型是__________,是____分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________。(a)中E原子的配位数为____。若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有____个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)____(b)(填“>”“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数, X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水, Z元素是地壳中含量最高的金属元素,W 的原子半径是第三周期中最小的。
(1)写出YX4+的电子式_______。
(2)写出Z与W所形成的盐与 YX3的水溶液反应的离子方程式________________。
(3)室温下,pH=3的XW溶液与pH=5的YX4W溶液中由水电离出的c(H+)的比为___。
(4)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0, 将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_____________________。
a.达到化学平衡时,任何一种物质表示的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中混合气体的平均相对分子质量减小
(5)有人设想寻求合适的催化剂和电极材料,以Y2、X2为电极反应物,以XW-YX4W 为电解质溶液制备新型燃料电池。请写出该电池的正极反应式_____________。
(6)汽车尾气中含有CO、NO、NO2等有毒气体,对汽车加装尾气净化装置,用含铂等过渡元素的催化剂催化,可使有毒气体相互反应转化成无毒气体。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+68 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2 (g) ΔH3=-393.5 kJ·mol-1
CO与NO2反应的热化学方程式为____________________,反应一定条件下可逆,温度不同(T2>T1二者均大于常温)、其他条件相同,下列图像正确的是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业品氢氧化钾溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。下列说法不正确的是
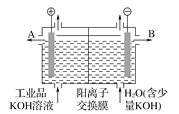
A. 阴极材料可以是Fe,含氧酸根杂质不参与电极上放电
B. 该电解槽的阳极反应式为:4OH―― 4e-= 2H2O+O2↑
C. 通电后,该电解槽阴极附近溶液pH会减小
D. 除去杂质后氢氧化钾溶液从出口B导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、c同周期,c、d同主族.a的原子结构示意图为 ![]() ,b与d形成的化合物的电子式为
,b与d形成的化合物的电子式为 ![]() ,则下列叙述中正确的是( )
,则下列叙述中正确的是( )
A.原子序数:a>b>c
B.d单质最活泼
C.原子半径:a>c>d
D.最高价氧化物对应的水化物的酸性:d>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述中,不正确的是( )
A. SiO2可用作制备光导纤维
B. Na、K合金熔点比任何一个组分低
C. 通过化学反应可实现12C到14C的转化
D. 晶体硅可用于制作太阳能光板、制造芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是( )
A. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B. 必需的定量仪器有100 mL量筒、250 mL容量瓶和托盘天平
C. 量取浓硫酸的体积为25.0 mL
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯酸钠(NaClO3)与盐酸反应的化学方程式为NaClO3+6HCl===NaCl+3Cl2↑+3H2O,则氧化产物和还原产物的质量比为( )
A. 6∶1 B. 5∶1 C. 3∶1 D. 2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com