【答案】
分析:(1)盐溶液促进水的电离,溶液中c(H
+)或c(OH
-)越大,水的电离程度越小,以此分析;
(2)从盐类的水解和弱电解质的电离程度角度分析;
(3)③和④等体积混合后,溶液溶质为NaCl和NH
4Cl,从盐类的水解角度分析;
(4)根据温度对电解质的电离影响判断温度的大小,根据c(H
+)=
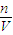
计算酸碱混合反应.
解答:解:(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H
+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H
+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(2)④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵等溶液中存在:NH
4++H
2O

NH
3?H
2O+H
+,其中硫酸铵溶液中铵根离子浓度最大,硫酸氢铵存在大量的H
+,抑制NH
4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,四种物质中NH
4+浓度最小,⑧氨水为弱电解质,难以电离,在这五种溶液中NH
4+浓度最小,所以有:⑥⑦④⑤⑧,
故答案为:⑥⑦④⑤⑧;
(3)③和④等体积混合后,溶液溶质为NaCl和NH
4Cl,由于溶液中存在:NH
3?H
2O

NH
4++OH
-,则c(Na
+)=c(CI
-)>c(NH
4+),c(OH
-)>c(H
+),又溶液中存在水的电离,则c(OH
-)>c(NH
4+),故有:c(Na
+)=c(CI
-)>c(OH
-)>c(NH
4+)>c(H
+)
故答案为:c(Na
+)=c(CI
-)>c(OH
-)>c(NH
4+)>c(H
+);
(4)t℃,K
W=1×10
-13,25℃,K
W=1×10
-14,已知水的电离为吸热过程,升高温度促进电离,K
W增大,所以t℃大于25℃,
t℃时将pH=11的NaOH溶液中c(OH
-)=
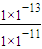
mol/L,
在t℃时将pH=11的NaOH溶液aL与pH=1的H
2SO
4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,
则有:
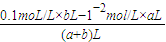
=0.01mol/L,则a:b=9:2,
故答案为:>;9:2.
点评:本题考查溶液离子浓度大小的比较以及盐类的水解和弱电解质的电离等问题,题目难度较大,易错点为(1)(2),注意把握影响盐类水解以及电解质的电离的因素.

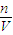 计算酸碱混合反应.
计算酸碱混合反应.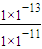 mol/L,
mol/L,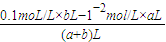 =0.01mol/L,则a:b=9:2,
=0.01mol/L,则a:b=9:2,

 名校课堂系列答案
名校课堂系列答案