
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO47H2O)的工业流程示意图如图: 
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 .
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 .
(3)反应釜中,烧渣经过反应转化为溶液I和固体.
①烧渣中的FeS在反应中做剂(填“氧化”或“还原”).
②溶液I中所含溶质的化学式是 .
(4)操作a的主要步骤是:加热浓缩、、过滤洗涤.
(5)流程中,固体X可以选择硫铁矿(FeS2)或;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2++═Fe2++SO42﹣+ .
【答案】
(1)增大反应物的接触面积,提高化学反应速率
(2)2SO2+O2 ![]() 2SO3
2SO3
(3)还原;Fe2(SO4)3、H2SO4
(4)冷却结晶
(5)Fe;14Fe3+;8H2O;16H+
【解析】解:(1)沸腾炉中,硫铁矿进行粉碎处理的目的是使固体与气体充分接触,加快反应速率,
故答案为:增大反应物的接触面积,提高化学反应速率;(2)接触室中,SO2与O2的反应生成SO3 , 反应的化学方程式为2SO2+O2 ![]() 2SO3 ,
2SO3 ,
故答案为:2SO2+O2 ![]() 2SO3;(3)①反应釜中的FeS被氧化成硫,所以FeS在反应中做还原剂,
2SO3;(3)①反应釜中的FeS被氧化成硫,所以FeS在反应中做还原剂,
故答案为:还原;
②根据上面的分析可知,溶液Ⅰ主要成分为硫酸铁及过量的硫酸,其化学式为Fe2(SO4)3、H2SO4 ,
故答案为:Fe2(SO4)3、H2SO4;(4)操作a为从硫酸亚铁溶液中获得硫酸亚铁晶体,其操作为加热浓缩、冷却结晶、过滤洗涤,
故答案为:冷却结晶;(5)流程中,固体X主要目的是将铁离子还原成亚铁离子,所以X可以是FeS2或Fe,硫铁矿(FeS2)与硫酸铁发生氧化还原反应生成亚铁离子和硫酸根离子,反应的离子方程式为FeS2+14Fe3++8H2O═15Fe2++2SO42﹣+16H+ ,
故答案为:Fe;14Fe3+、8H2O、16H+ .
硫铁矿在沸腾炉中高温生成氧化铁与二氧化硫,混合气体Ⅰ为二氧化硫和空气,经过接触室后二氧化硫被氧化成三氧化硫,所以混合气体Ⅱ为三氧化硫、二氧化硫、空气等,沸腾炉中产生的炉渣主要为硫化亚铁、氧化铁、二氧化硅等,加入硫酸溶解,再用氧气氧化可得溶液Ⅰ主要成分为硫酸铁,硫酸铁中加入铁粉得溶液Ⅱ为硫酸亚铁溶液,经蒸发浓缩、冷却结晶得到硫酸亚铁晶体,烧渣用酸溶解后得固体主要成分为二氧化硅和硫,硫经氧化得二氧化硫,可循环利用,(1)固体粉碎处理可使固体与气体充分接触,加快反应速率;(2)接触室中,SO2与O2的反应生成SO3;(3)①反应釜中的FeS被氧化成硫,据此答题;②根据上面的分析可知,溶液Ⅰ主要成分为硫酸铁及过量的硫酸;(4)操作a为从硫酸亚铁溶液中获得硫酸亚铁晶体,可以用降温结晶的方法;(5)流程中,固体X主要目的是将铁离子还原成亚铁离子,据此书写离子方程式.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图,请参照元素①~⑨在表中的位置,用化学用语回答下列问题: 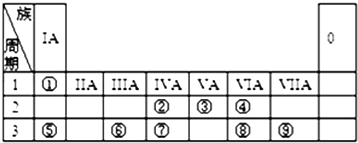
(1)已知②的一种核素中子数为8,则其气态氢化物的摩尔质量为
(2)①②⑤⑥的原子半径由大到小的顺序为(填元素符号);⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是(填化学式): .
(3)⑥的最高价氧化物可以与⑤的最高价氧化物对应水化物的溶液能发生反应,该反应的化学方程式为:
(4)X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④组成,X与Y的反应是潜水艇和呼吸面具中氧气的来源.X的电子式是 , Y中含有的化学键类型是 .
(5)某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来一次性完成的②、⑦非金属性强弱比较的实验研究. 
甲同学设计实验的依据是;其中装置B中所盛试剂的作用为;C中反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g)2NH3(g)(正反应为放热反应),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( ) 
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4 , 无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:
(1)联氨分子的电子式为 , 其中氮的化合价为 .
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 .
(3)①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJmol﹣1
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭推进剂的主要原因为 .
(4)联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为(已知:N2H4+H+N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为 .
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( ) 
A.该反应是吸热反应
B.断裂1 mol A﹣A键和1 mol B﹣B键能放出x kJ的能量
C.断裂2 mol A﹣B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A,B两元素形成的化合物可表示为( )
A.BA2
B.BA3
C.A3B2
D.B3A2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,各原子最外层电子数之和为10.A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数.则下列叙述不正确的是( )
A.D元素处于元素周期表中第三周期ⅣA族
B.四种元素的原子半径:A<B<D<C
C.B,D的氧化物均为酸性氧化物
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验可达到实验目的是( )
①将 ![]() 与NaOH的醇溶液共热制备CH3﹣CH═CH2
与NaOH的醇溶液共热制备CH3﹣CH═CH2
② ![]() 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备 ![]()
③向CH3CH2Br中滴入AgNO3溶液以检验溴元素
④用溴水即可检验CH2=CH﹣CHO中的碳碳双键.
A.只有①③④
B.只有①④
C.只有①
D.都不能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( ) 
A.负极发生还原反应
B.电子由锌片通过导线流向铜片
C.该装置能将电能转化为化学能
D.铜片上发生的反应为Cu2++2e﹣═Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com