
分析 (1)铵盐和碱反应生成氨气,实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水;
(2)一水合氨为弱碱,溶于水存在部分电离,依据化学平衡原理解释加入NH4Cl固体后平衡移动方向以及pH的变化;
(3)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值.
解答 解:(1)实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3•H2O?NH4++OH-,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,
故答案为:NH3•H2O?NH4++OH-;降低;
(3)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑;化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数为K=c(N2O)×c2(H2O),
故答案为:NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑;K=c(N2O)×c2(H2O).
点评 本题主要考查实验室制取氨气原理以及弱电解质的电离、电离平衡的影响因素,注意掌握氮及其化合物的性质,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCl | B. | CH3C(CH3)2Br | C. | (CH3)3CCOOCH(CH3)2 | D. | CH3C(CH3)2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②⑤⑥ | C. | ①④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
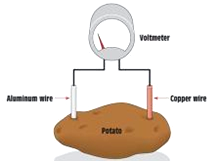 以色列研究人员宣布已研制出一种利用煮熟土豆发电的有机电池,具有构造简单、可持续利用等特点.图为土豆电池,这种绿色高效能的电池由锌、铜电极和煮熟的土豆片制成的.下列关于土豆电池叙述正确的是( )
以色列研究人员宣布已研制出一种利用煮熟土豆发电的有机电池,具有构造简单、可持续利用等特点.图为土豆电池,这种绿色高效能的电池由锌、铜电极和煮熟的土豆片制成的.下列关于土豆电池叙述正确的是( )| A. | 锌为电池的正极 | |
| B. | 铜极上发生氧化反应 | |
| C. | 该电池工作时电子由锌电极经外电路流向铜电极 | |
| D. | 该电池是将电能转化为生物质能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com