
CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。以下是用铜粉氧化法生产CuO的流程图:

回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98% H2SO4与1体积水混合而成。配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是______________(写分子式),应加以回收处理。
(4)已知Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(2Cu+![]() Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。
Cu+Cu2+)。请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含有Cu2O。
。
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和________________________(用文字表示)。
(1)CuO+2H+→Cu2++H2O(2)烧杯、量筒(3)SO2(4)取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之则没有(5)铜粉的质量 最终所得CuO的质量。
本题考查工业流程题。(1)氧化铜与硫酸反应的离子方程式;(2)配制硫酸溶液需要的玻璃仪器有烧杯、量筒和玻璃棒;(3)因为是1:1的硫酸,浓度较大,铜没有氧化完全,可能含有部分的Cu2O,与硫酸反应氧化还原反应,生成二氧化硫气体;(4)取少许样品,加入稀H2SO4,若溶液中出现红色沉淀,说明样品中中含有Cu2O,反之则没有;(5)如果铜没有损耗,则根据铜元素的守恒,测得最终所得CuO的质量即可求出样品铜的质量,再测得原铜粉的质量,就可以求出铜粉中Cu的含量。


科目:高中化学 来源: 题型:
 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.

| ||
| ||


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
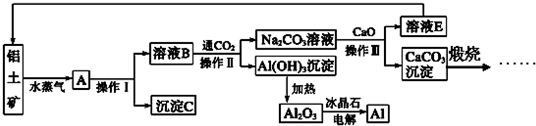
查看答案和解析>>
科目:高中化学 来源:江苏省2007年高考化学模拟试题 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)CuO可用作颜料、玻璃磨光剂、有机合成催化剂等。以下是用铜粉氧化法生产CuO的流程图:

回答下列问题:
(1)写出溶解过程中的离子方程式_____________________________________。
(2)1∶1的H2SO4是用1体积98% H2SO4与1体积水混合而成。配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要______________、________________。
(3)该工艺会产生一定量的酸性气体,该气体是______________(写分子式),应加以回收处理。
(4)已知Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差
请你设计一个简单的实验检验焙烧后固体(假设只含铜的氧化物)中是否含
Cu2O。 。
(5)不考虑生产中的损耗,要计算铜粉中Cu的含量,需要测定的数据是_______________和________________________(用文字表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com