
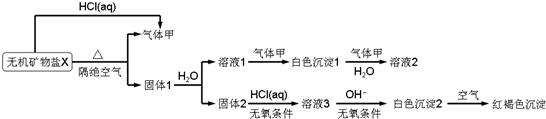
 ,气体甲是二氧化碳,二氧化碳的电子式为
,气体甲是二氧化碳,二氧化碳的电子式为 ,
, ;
; ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| A、乙烯可作水果的催熟剂 |
| B、硅胶可作袋装食品的干燥剂 |
| C、福尔马林可作食品的保鲜剂 |
| D、氢氧化铝可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+,无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+,无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ?mol-1) | 786 | 715 | 3401 |
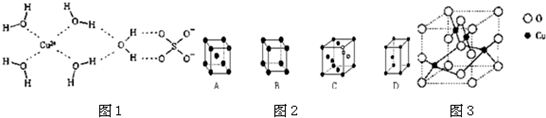
查看答案和解析>>
科目:高中化学 来源: 题型:
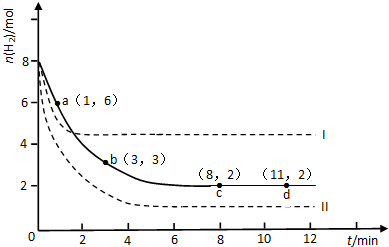
查看答案和解析>>
科目:高中化学 来源: 题型:
 某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热某废塑料得到的产物如表:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| ① |
| ② |
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
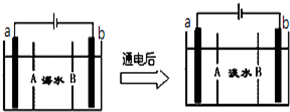
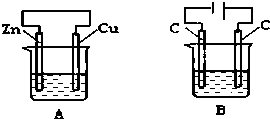 仔细观察图A、B两个装置,两个烧杯分别盛有足量的CuSO4溶液,回答问题:
仔细观察图A、B两个装置,两个烧杯分别盛有足量的CuSO4溶液,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com