
9.6 g元素A与4.2 g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%.试计算A、B两元素的相对原子质量,并推算出它们在周期表中的位置.
答案:32 第3周期ⅥA族 14 第2周期ⅡA族
解析:(1)设A的氢化物分子式为HxA,最高价氧化物分子式应该是A2O8-x,通过题给条件求出A的相对原子质量,(2)再利用题目中A、B质量关系和原子个数关系求出B的相对原子质量,根据两种元素原子的质子数确定在周期表中的位置.
设该氢化物为HxA,该最高价氧化物分子式应该为:A2O8-x
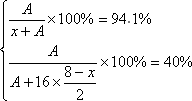 x=2,A=32
x=2,A=32
由于9.6 g元素A与4.2 g元素B含有相同的原子数,设B的相对原子质量为y,由![]()
解得:y=14
所以,A的相对原子质量是32,其中子数与质子数相等,因此质子数为16的是硫元素,在第3周期ⅥA族.B的相对原子质量是14,其中子数与质子数相等,因此质子数为7的是氮元素,在第2周期ⅡA族.


科目:高中化学 来源:设计必修二化学鲁科版 鲁科版 题型:038
9.6 g元素A与4.2 g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%.试计算A、B两元素的相对原子质量,并推算出它们在周期表中的位置.
查看答案和解析>>
科目:高中化学 来源:浙江省杭州外国语学校2011届高三11月月考化学试题 题型:038
9.6 g元素A与4.2 g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%.推算出A、B在周期表中的位置.(请写出计算、推理过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com