
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】用干燥洁净的铂丝蘸取某试样灼烧时,焰色反应为黄色,下列判断正确的是( )
A.该试样一定是钠的化合物B.该试样一定含有钠元素
C.该试样一定是金属钠D.不能确定该试样中是否含有钠元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )

A. X和R在同一周期
B. 原子半径:W>R>X
C. 气态氢化物的稳定性:Y>X
D. X、Z形成的化合物中只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域可以寻找制备新型农药材料的元素,它们是( )
A.左下方区域的金属元素
B.右上方区域的某些非金属元素
C.金属元素和非金属元素分界线附近的元素
D.过渡元素区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关碱金属性质的叙述错误的是( )
A.随核电荷数的增加,碱金属的熔、沸点降低
B.随核电荷数的增加,碱金属的密度增大
C.锂在氧气中燃烧生成过氧化锂
D.碱金属与水反应生成碱和氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z在元素周期表中的位置关系如图,其中X是短周期中原子半径最大的金属元素,Y的单质在常温下为淡黄色固体,下列有关说法正确的是

A. Y的简单氢化物的热稳定性比W、Z的都强
B. 四种元素的简单离子具有相同的电子层结构
C. X的氧化物结构中阴阳离子之比为1:2
D. Y的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
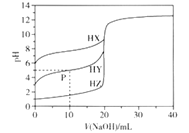
A. 电离常数Ka(HX)的数量级为10-12
B. HX的电离程度大于X-的水解程度
C. pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. CO的平衡转化率为80%
C. 通入CO后,正反应速率逐渐增大
D. 反应前H2S物质的量为7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.01mol氯化铬(CrCl3·6H2O)在水溶液中用过量的AgNO3处理,产生0.01mol AgCl沉淀,此氯化铬最可能是( )
A. [Cr(H2O)6]Cl3 B. [Cr(H2O)5Cl]Cl2·H2O
C. [Cr(H2O)4Cl2]Cl·2H2O D. [Cr(H2O)3Cl3]·3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com