
| A. | ②①③④ | B. | ①③④② | C. | ④③①② | D. | ③④②① |
分析 对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液PH越大;当PH相同时,酸越强,盐的浓度越大.
解答 解:在相同的条件下测得①NaClO③NaHCO3 ④CH3COONa三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即④>③>①,NaOH为强碱,等pH时其浓度最小,则④>③>①>②,
故选C.
点评 本题考查了盐类的水解,会运用逆向思维进行分析解答本题,注意盐溶液的碱性强弱取决于阴离子的水解能力,当pH相同时,越难水解的盐,其浓度越大,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | X>Z>Y>W | B. | Z>X>Y>W | C. | Z>Y>X>W | D. | Z>W>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(5s)>E(4f)>E(4s)>E(3d) | B. | E(4f)>E(3d)>E(4s)>E(3p) | C. | E(5d)>E(4d)>E(3d)>E(2d) | D. | E(5s)>E(4s)>E(4f)>E(3d) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
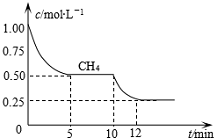
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
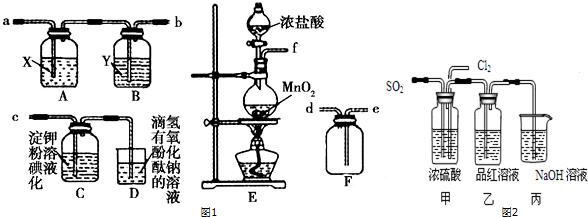
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com