
【题目】美国科学家将铅和氪两种元素的原子核对撞,获得一种质子数为118、质量数为293的新元素,该元素原子核内的中子数和核外电子数之差为( )
A.47B.57C.67D.175
科目:高中化学 来源: 题型:
【题目】将一定质量Mg、Zn、Al的混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),则原混合物的质量不可能是( )
A.2g B.4g C.6g D.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压、不做功时,反应A+B===C+D在下列哪种情况下,一定能自发进行( )
A. ΔH<0、ΔS<0 B. ΔH>0、ΔS<0 C. ΔH<0、ΔS>0 D. ΔH>0、ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以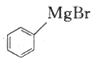 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
X | L层p电子数比s电子数多2个 |
Y | 第三周期元素的简单离子中半径最小 |
Z | L层有三个未成对电子 |
(1)写出元素X的离子结构示意图__________。
(2)写出Y元素最高价氧化物的水化物分别与HCl、NaOH溶液反应的离子方程式_______________________、_________________________。
(3)写出Z与Y的电子排布式______________、________________。
(4)元素T与氯元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是__________(填元素符号),理由是________________________________________________。
【答案】 ![]() Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO
Al(OH)3+3H+===Al3++3H2O Al(OH)3+OH-===AlO![]() +2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
+2H2O 1s22s22p3 1s22s22p63s23p1 F CE Al 具有金属性
【解析】试题分析:T单质能与水剧烈反应,所得溶液呈弱酸性,所以T是F元素;X元素的L层p电子数比s电子数多2个,X元素是O元素;Y元素是第三周期元素的简单离子中半径最小,Y是Al元素;Z元素L层有三个未成对电子,Z是N元素;
解析:根据以上分析,(1)X为O元素,氧离子核外最外层达到8电子稳定结构,氧离子结构示意图![]() 。
。
(2)Y元素最高价氧化物水化物Al(OH)3,为两性氢氧化物,与盐酸反应生成氯化铝和水,离子方程式为Al(OH)3+3H+===Al3++3H2O;与氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al(OH)3+OH-===AlO![]() +2H2O;
+2H2O;
(3)Z是N元素,电子排布式是1s22s22p3; Y是Al元素,电子排布式是1s22s22p63s23p1。
(4)T是F元素,同主族元素从上到下,非金属性减弱,与氯元素相比,非金属性较强的是F;
A.气态氢化物的挥发性不能证明非金属性的强弱,故A错误;
B.单质分子中的键能,不能证明非金属性的强弱,故B错误;
C.非金属性越强,电负性越大,根据两元素的电负性可以判断非金属性,故C正确;
D.根据最高价含氧酸的酸性可以判断非金属性,故D错误;
E.键长越长,越不稳定,
F.单质在自然界中的存在形式,不能判断非金属性,故F错误。
(5)Al为金属元素,具有金属性,其它三种元素为非金属元素,具有较强的非金属性。
点睛:元素非金属性强弱的判断方法:①越易与氢气化合,非金属性越强;②气态氢化物越稳定,非金属性越强;③单质的氧化性越强,非金属性越强;④最高价含氧酸的酸性越强,非金属性越强。
【题型】综合题
【结束】
21
【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为__________。
(2)在化合物YZ2中Y的化合价为__________;Y2-与Na+的半径大小为__________。
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是__________;X与Y的第一电离能:X__________Y(填“<”、“>”或“=”),其理由是__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com