
短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则X、Y两元素形成的化合物可能具有的性质是
A.和水反应 B.和硫酸反应
C.和氢氧化钠反应 D.和氯气反应
科目:高中化学 来源: 题型:
下列事实能用勒沙特列原理解释的是( )
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 ②实验室中用氯化钠固体与浓硫酸共热制取氯 化氢气体 ③用排饱和食盐水法收集Cl2 ④温度控制在500℃有利于合成氨反应 ⑤工业制取金属钾Na(l)+ KCl(l) 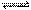 NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
A.②③⑤ B.①③⑤ C.①②③④⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在空气吹出法的工艺中,有选用纯碱溶液作溴蒸气吸收剂的,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是
A.两种吸收过程中,Br2只作氧化剂
B.两种吸收过程都发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱作还原剂
D.用纯碱溶液作吸收剂只发生了复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
科学研究证明:核外电子的能量不仅与电子所处的能层、能级有关,还与核外电子的数目及核电荷的数目有关。氩原子与硫离子的核外电子排布相同,都是[Ne]3s23p6。下列说法正确的是
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子都达8电子稳定结构,化学性质相同
D.两粒子的电子发生跃迁时,产生的光谱不同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法中正确的是
①12C和14C的化学性质相同 ②37Cl原子核内中子数为17 ③12CO2和14CO2互为同位素 ④Ca和Ca2+是同种元素,且性质相同 ⑤37Cl-的结构示意图为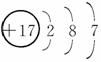
A.②③ B.③④
C.①④⑤ D.①
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y元素原子最外层电子数与核外电子总数之比为3∶4,M元素原子的最外层电子数与次外层电子数之比为3∶4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的电子式_______________________________________。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式______________________________________________________________(分解反应)。
(3)下表表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________________________________。
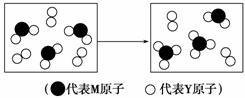
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1∶1∶1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为________,B的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
膳食纤维具有突出的保健功能,是人体的“第七营养素”。木质素是一种非糖类膳食纤维。其单体之一——芥子醇结构简式如下图所示。下列有关芥子醇的说法正确的是( )
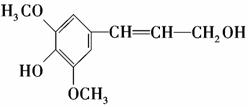
A.芥子醇分子中有两种含氧官能团
B.芥子醇分子中所有碳原子不可能在同一平面上
C.芥子醇与足量浓溴水反应,最多消耗3 mol Br2
D.芥子醇能发生的反应类型有氧化、取代、加成
查看答案和解析>>
科目:高中化学 来源: 题型:
电子表和电子计算器的电源常用微型银锌原电池,其电极分别为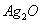 和
和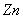 ,电解质溶液为
,电解质溶液为 溶液,放电时锌极上的电极反应是
溶液,放电时锌极上的电极反应是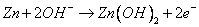 ;氧化银电极上的反应式为
;氧化银电极上的反应式为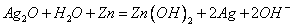 ,总反应式为
,总反应式为 ,下列说法正确的是( )
,下列说法正确的是( )
A、锌是负极,氧化银是正极
B、锌发生还原反应,氧化银发生氧化反应
C、溶液中OH-向正极移动, 、
、 向负极移动
向负极移动
D、随着电极反应的不断进行,电解质溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:

 已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是______________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com