
 X是一种天然有机物,其结构简式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是重要的有机合成原料.下列关于物质X的说法正确的是 ( )
X是一种天然有机物,其结构简式如图所示,常被用于香料或作为饮料的酸化剂,在食品和医学上用作多价螯合剂,也是重要的有机合成原料.下列关于物质X的说法正确的是 ( )| A、X不能发生消去反应 |
| B、1 mol物质X可以和4 mol NaOH反应 |
| C、X的核磁共振氢谱中有6个峰 |
| D、等物质的量的X分别与足量的Na、NaHCO3反应得到的气体物质的量后者大 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
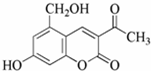 (Ⅰ)多项选择题
(Ⅰ)多项选择题
| NaCN |
| H2O |

| 反应物 |
| 反应条件 |
| 反应物 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、羟氨苄青霉素在空气中不能稳定存在 |
| B、每个羟氨苄青霉素分子中含有3个手性碳原子 |
| C、羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应 |
| D、1mol羟氨苄青霉素与氢氧化钠溶液反应时,最多消耗4molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述 | 叙述 |
| A | Al是较活泼金属 | 工业用电解法冶炼Al |
| B | 未打磨的镁条加盐酸开始几乎无气泡 | MgO不与盐酸反应 |
| C | 铁粉加入KSCN溶液中变红 | 可用KSCN检验Fe3+ |
| D | 加热可加快Zn与稀硫酸的反应速率 | Zn与稀硫酸反应是吸热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 用玻璃棒蘸取X溶液沾到淀粉KI试纸上 | 试纸变蓝色 | X溶液一定是氯水 |
| B | 向稀HNO3和稀H2SO4中分别加入Fe粉 | 均有气泡冒出 | 两者均发生氧化还原反应 |
| C | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向Al2(SO4)3溶液中滴加NaOH溶液至过量 | 溶液先浑浊后澄清 | Al(OH)3可溶于强碱溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com