
【题目】肼(![]() ,无色液体)是一种用途广泛的化工原料。实验室中先制备次氯酸钠,再用次氯酸钠溶液和氨反应制备肼并验证肼的性质。实验装置如图所示。
,无色液体)是一种用途广泛的化工原料。实验室中先制备次氯酸钠,再用次氯酸钠溶液和氨反应制备肼并验证肼的性质。实验装置如图所示。
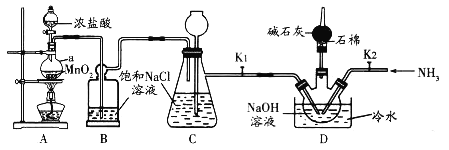
已知:![]()
![]() 。当温度超过40℃时,
。当温度超过40℃时,![]() 与
与![]() 溶液反应生成
溶液反应生成![]() 。
。
回答下列问题:
(1)装置B的作用是______________。
(2)为控制D装置中的反应温度,除用冷水浴外,还需采取的实验操作是_________。
(3)当三颈烧瓶中出现黄绿色气体时立即关闭分液漏斗活塞、移去酒精灯、关闭![]() 。此时装置C的作用是_______________。
。此时装置C的作用是_______________。
(4)将D装置水槽中的冷水换为热水,把三颈烧瓶中黄绿色气体赶走后,打开![]() ,通入
,通入![]() ,使其与
,使其与![]() 溶液反应制取肼。理论上通入三颈烧瓶的
溶液反应制取肼。理论上通入三颈烧瓶的![]() 和
和![]() 的最佳物质的量之比为______。
的最佳物质的量之比为______。
(5)请从提供的下列试剂中选择合适试剂,设计合理的实验方案验证肼的还原性(说明操作、现象和结论)。____________。
①淀粉-![]() 溶液 ②稀硫酸(酚酞) ③
溶液 ②稀硫酸(酚酞) ③![]() ④
④![]()
【答案】除去![]() 中的
中的![]() 控制浓盐酸的滴加速度或控制A处加热温度 储存氯气
控制浓盐酸的滴加速度或控制A处加热温度 储存氯气 ![]() 取少量
取少量![]() 于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。
于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。
【解析】
(1)A中制取的Cl2中含有HCl,应用饱和氯化钠除去;
(2)由已知条件可知,过量的氯气和氢氧化钠反应是放热反应,所以可以控制氯气的产生速率达到降温的目的;
(3)关闭分液漏斗活塞、移去酒精灯时,A中的反应并未立即停止,还会继续产生Cl2,关闭K1,A、B是密闭体系,C起到储气瓶的作用;
(4)氯气通入D中,发生反应:Cl2![]() 2NaOH=NaCl
2NaOH=NaCl![]() NaClO
NaClO![]() H2O,通入氨气后发生反应:NaClO
H2O,通入氨气后发生反应:NaClO![]() 2NH3=N2H4
2NH3=N2H4![]() NaCl
NaCl![]() H2O,通过两个方程式可以找到通入Cl2和NH3物质的量之比;
H2O,通过两个方程式可以找到通入Cl2和NH3物质的量之比;
(5)要证明N2H4的还原性,需要用有氧化性的物质与其反应。
(1)A中制取的Cl2中含有HCl,B中盛有饱和氯化钠,用以除去HCl;
本题答案为:除去Cl2中的HCl。
(2)由已知条件可知,过量的氯气和氢氧化钠反应是放热反应,所以可以控制氯气的产生速率达到降温的效果,控制浓盐酸的滴加速度或控制A处加热温度,可控制Cl2产生速率,以免过量氯气和氢氧化钠反应;
本题答案为:控制浓盐酸的滴加速度或控制A处加热温度。
(3)关闭分液漏斗活塞、移去酒精灯时,A中的反应并未立即停止,还会继续产生Cl2,关闭K1,A、B装置是密闭体系,C起到储气瓶的作用;
本题答案为:储存氯气。
(4)氯气通入D中,发生反应:Cl2![]() 2NaOH=NaCl
2NaOH=NaCl![]() NaClO
NaClO![]() H2O,通入氨气后发生反应:NAClO
H2O,通入氨气后发生反应:NAClO![]() 2NH3=N2H4
2NH3=N2H4![]() NaCl
NaCl![]() H2O,通过两个方程式可以知道,理论上通入三颈烧瓶的
H2O,通过两个方程式可以知道,理论上通入三颈烧瓶的![]() 和
和![]() 的最佳物质的量之比为:1:2;
的最佳物质的量之比为:1:2;
本题答案为:1:2。
(5)要验证肼的还原性,则需要选择氧化剂,AgCl中Ag+具有氧化性,故选择AgCl,操作现象及结论为:取少量AgCl于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性;
本题答案为:取少量![]() 于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。
于试管中,加入肼溶液,固体逐渐变黑,并有气泡产生,说明肼有还原性。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述是可逆反应N2(g)+3H2(g)![]() 2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
2NH3(g),在定容密闭容器中达到平衡的标志的是 ( )
①NH3的生成速率与NH3的分解速率相等;
②单位时间内amolN2生成,同时生成3amolH2;
③N2的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦N2、H2、NH3的分子数目比为1:3:2;
A.②⑤ B.①③④⑤ C.②⑥⑦ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
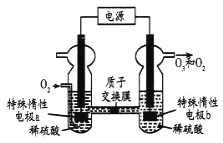
A. 电极a为阴极
B. 标准状况下,当![]() 反应时收集到
反应时收集到![]() 和
和![]() 混合气体
混合气体![]() ,
,![]() 的体积分数为80%
的体积分数为80%
C. 电解一段时间后b极周围的![]() 下降
下降
D. a极的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖尿病是由于人体内胰岛素紊乱导致的代谢紊乱综合征,以高血糖为主要标志。长期摄入高热量食品或缺少运动,都会导致糖尿病。
(1)血糖是指血液中的葡萄糖,下列有关说法正确的是______________。
A.葡萄糖分子可表示为C6(H2O)6,则每个葡萄糖分子含有6个H2O分子
B.葡萄糖与果糖互为同分异构体
C.糖尿病人尿糖较高,可用新制的氢氧化铜来检测人尿液中的葡萄糖
D.淀粉水解的最终产物是氨基酸
(2)糖尿病人不可过量饮酒,将会一定程度上造成胰岛细胞损伤。但酒精在肝脏内可转化成有机物A。A的实验结果如下:
①通过实验测得A的相对分子质量为60;
②A由C、H、O三种元素组成,分子中只存在两种类型的氢原子,且这两种类型的氢原子个数比为1∶3
③A可与酒精在一定条件下生成有芳香气味的物质。
纯净的A又称为______________,结构简式为____________________。
A的主要化学性质有(用化学方程式表示):a____________________________________,
b___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
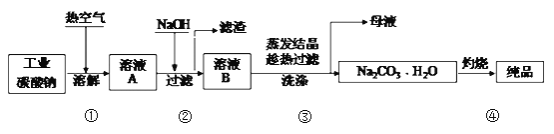
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3H2O中混有Na2CO310H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于共价键的说法正确的是( )
A.丙炔分子中含有5个σ键和2个π键
B.乙醇分子中O-H键的极性强于C-H键的极性
C.乙烷分子中只含有极性键不含有非极性键
D.分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是

A. 电池放电时Na+从a极区移向b极区
B. 电极b采用Pt/C,该极溶液的pH增大
C. 该电池a极的反应为BH4-+8OH--8e-===BO2-+6H2O
D. 电池总反应:BH4- + 4H2O2 === BO2- + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
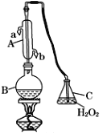
(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Al3+、Fe2+、Fe3+、Cu2+、Ag+、CO32-、S2-、SO32-、AlO2-、Cl-、SO42-中的一种或几种,对该溶液进行实验,结果如图:

下列说法不正确的是( )
A. 淡黄色沉淀甲为AgBr,沉淀乙为Al(OH)3
B. 溶液中一定含有Na+、S2-、SO32-、AlO2-
C. 气体甲的成分可能是CO2或SO2或H2S或CO2、SO2的混合气体或CO2、H2S的混合气体
D. 确定溶液A中是否含有SO42-,可在沉淀丙中加入足量稀盐酸,若沉淀部分溶解则溶液A中含有SO42-,若沉淀全部溶解则溶液A中不含SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com