
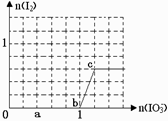
已知:还原性HSO3¯>I¯,氧化性IO3¯> I2 。在含3 mol NaHSO3的溶液中逐滴加入KIO3
溶液。加入KIO3和析出I2的物质的量的关系曲线如下图
所示。下列说法不正确的是
A.0~b间反应:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+
B.a点时消耗NaHSO3的物质的量为1.2 mol
C.b~c间反应:I2仅是氧化产物
D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的
KIO3 为1.08mol
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
由FeO、Fe3O4和Fe2O3组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则该混合物中FeO、Fe3O4、Fe2O3的物质的量之比可能是( )。
A.1∶1∶2 B.2∶1∶1 C.1∶2∶2 D.1∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。下列判断不正确的是
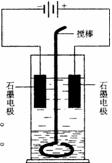 A. 原上层液体是可能是KI的水溶液,原下层液体可能是CCl4
A. 原上层液体是可能是KI的水溶液,原下层液体可能是CCl4
B. 搅拌后两层液体颜色发生变化的原因是I2在CCl4中的溶解
度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
C. 阴极区域pH增大的原因是水分子得电子生成了OH—
D. 阳极上的电极反应式2H++2e - =H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是
A.若D是一种白色沉淀,在空气中最终变为
红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
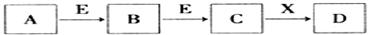
查看答案和解析>>
科目:高中化学 来源: 题型:
用36.5%的浓盐酸(密度1.2 g·cm-3)配1 mol·L-1的稀盐酸 100 mL,配制过程所用仪器,且使用先后顺序正确的是
①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④电子天平 ⑤100 mL容量瓶
⑥胶头滴管 ⑦玻璃棒
A.①③⑤⑥⑦ B.②③⑦⑤⑥ C.③⑤⑦⑥① D.④③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数
占核外电子总数的3/4,W—、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周
期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)Z在元素周期表中的位置 ,工业上生产Z单质的化学方程式为
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH
均大于7,组成元素的原子数目比均为1∶1∶1。若A能抑制水的电离,而B能促进水的电
离,则A、B的化学式分别为 、 。
(3)C是由上述四种元素的两种组成的相对分子质量为34的化合物,则C的电子式 。
(4)用B在碱性条件下可以处理CN—的工业废水,请将下列6种微粒:CN—、CO32—
N2、OH—、B的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式: + + ═ + + + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应2AB(g) C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
C(g)+ 3D (g)在高温下能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为
A.ΔH <0,ΔS>0 B.ΔH <0,ΔS<0
C.ΔH >0,ΔS>0 D.ΔH >0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
中华人民共和国国家标准(GB2760-200-)规定葡萄酒中SO2最大使用量为0.25g·L-1.某兴趣小组用题9图I装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
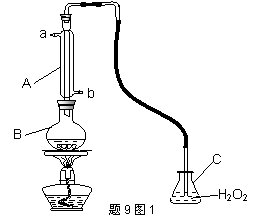

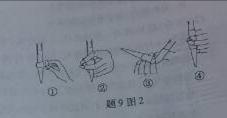
 (1)仪器A的名称是 ,水通入A的进口为 。
(1)仪器A的名称是 ,水通入A的进口为 。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 。
(3)除去C中过量的H2O2,然后用0.0900mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题9图2中的 ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)
(①=10mL,②=40mL,③<10mL,④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为 g·L-1
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com