
°Њћвƒњ°њI°Ґќ™≤вґ®љр фƒ∆—щ∆Ј£®±н√ж”– Na2O£©÷–ƒ∆µ•÷ µƒ÷ ЅњЈ÷ э£ђ…иЉ∆ЅЋ»зѕ¬ µ—й£®Јі”¶„∞÷√»з”“ЌЉ Ћщ Њ£©£Ї
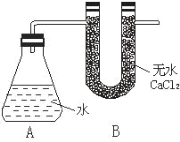
Ґў≥∆Ѕњ A°ҐB µƒ„№÷ Ѕњ
ҐЏ≥∆»°“їґ®÷ Ѕњµƒƒ∆—щ∆Ј
ҐџљЂƒ∆—щ∆ЈЌґ»л„ґ–ќ∆њ÷–£ђ—ЄЋў»ыљфіш U –ќЄ…‘пє№£®ƒЏЇђќёЋЃ CaCl2 Є…‘п ЉЅ£©µƒѕр∆§»ы ”–єЎ эЊЁ «£Ї≥∆»°µƒљр фƒ∆—щ∆Ј÷ Ѕњќ™ a g£ђA°ҐB Јі”¶«∞„№÷ Ѕњќ™ b g£ђЈі”¶Їу A°ҐB µƒ„№÷ Ѕњќ™ c g°£ «лЄщЊЁћв“вїЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©A ÷–ƒ∆ЇЌЋЃЈі”¶єэ≥ћњ…њіµљƒ∆»џ≥……ЅЅЅµƒ–°«т£ђ≤ъ…ъ’в“їѕ÷ѕу‘≠“т «£Ї_____________
£®2£©”√ a°Ґb°Ґc ±н Њµƒƒ∆µ•÷ µƒ÷ ЅњЈ÷ эќ™_______________
£®3£©»зєы√ї”– B „∞÷√ґ‘ µ—йљбєы”–Їќ”∞ѕм___________°££®ћо°∞∆Ђіу°±їт°∞∆Ђ–°°±°∞≤ї”∞ѕм°±£©
II°Ґѕ÷”√љр фƒ∆ЇЌњ’∆ш÷∆±Єіњґ»љѕЄяµƒ Na2O2£ђњ…јы”√µƒ„∞÷√»зѕ¬ЌЉ°£їЎірѕ¬Ѕ–ќ ћв£Ї
£®ћб Њ£ЇNa2O2 њ…“‘”л H2O°ҐCO2 Јі”¶£©
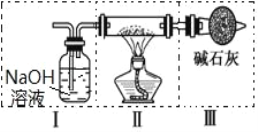
£®4£©…ѕ ц„∞÷√Ґф÷– ҐЈ≈µƒ ‘ЉЅ «_____£ђќ™Ќк≥… µ—锶љЂ„∞÷√Ґфљ”‘Џ_____£®ћо–і„÷ƒЄЇ≈£©°£
A.I ÷Ѓ«∞ B. I ЇЌ II ÷ЃЉд C. II ЇЌ III ÷ЃЉд D. III ÷ЃЇу
£®5£©µг»ЉЊ∆ЊЂµ∆Їу£ђєџ≤мµљ„∞÷√ II ÷–µƒѕ÷ѕуќ™_____°£
£®6£©„∞÷√ II ÷– Na …ъ≥… Na2O2 µƒїѓ—ІЈі”¶Јљ≥ћ љќ™_____°£
°Њір∞Є°њЄ√Јі”¶ќ™Ј≈»»£ђƒ∆µƒ»џµгµЌ23(a£Ђb£≠c)/a∆Ђіу≈®ЅтЋбBƒ∆»џїѓ≥…євЅЅµƒ–°«т£ђЊзЅ“»Љ…’≤ъ…ъї∆…Ђїр—ж£ђ…ъ≥…µ≠ї∆…Ђєћће2Na£ЂO2![]() Na2O2
Na2O2
°Њљвќц°њ
Ґс. ≤вґ®љр фƒ∆—щ∆Ј£®±н√ж”– Na2O£©÷–ƒ∆µ•÷ µƒ÷ ЅњЈ÷ э£ђјы”√ƒ∆ЇЌЋЃЈі”¶Ј≈≥ц«в∆ш£ђґшNa2O”лЋЃЈі”¶…ъ≥…«в—хїѓƒ∆≤їЈ≈≥ц«в∆ш£ђЈі”¶«∞A°ҐB „№÷ Ѕњ£®b g£©”лљр фƒ∆—щ∆Ј÷ Ѕњ£®a g£©÷ЃЇЌ”лЈі”¶Їу A°ҐB µƒ„№÷ Ѕњ£® c g£©µƒ≤о£ђЉі «…ъ≥…«в∆шµƒ÷ Ѕњ£ђЄщЊЁƒ∆ЇЌЋЃЈі”¶µƒїѓ—ІЈљ≥ћ љЅ–±»јэ љЉ∆Ћгњ…«у≥цљр фƒ∆—щ∆Ј÷–ƒ∆µƒ÷ Ѕњ£ђ»їЇуЄщЊЁƒ∆µƒ÷ ЅњЇЌ—щ∆Јµƒ÷ ЅњЉ∆Ћгƒ∆µƒ÷ ЅњЈ÷ э£їB„∞÷√÷–ќёЋЃ¬»їѓЄ∆µƒ„ч”√ «ќь ’«в∆ш÷–їм”–µƒЋЃ’ф∆ш£ђЉх…ў µ—йќу≤о°£
II£Ѓ”√љр фƒ∆ЇЌњ’∆ш÷∆±Є Na2O2£ђїѓ—ІЈљ≥ћ «ќ™2Na£ЂO2![]() Na2O2£ђѕ÷ѕуќ™»џїѓ≥…євЅЅµƒ–°«т£ђЊзЅ“»Љ…’≤ъ…ъї∆…Ђїр—ж£ђ…ъ≥…µ≠ї∆…Ђєэ—хїѓƒ∆єћће°£“тќ™Na2O2 њ…“‘”л H2O°ҐCO2 Јі”¶£ђ…иЉ∆„∞÷√I”√«в—хїѓƒ∆»№“Їќь ’CO2£ђ”√„∞÷√IV„∞”–≈®ЅтЋбЄ…‘п—х∆ш£ђ„∞÷√III÷– Ґ”–Љо ѓї“њ…Јј÷єњ’∆ш÷–ЋЃ’ф∆шљш»лЈі”¶„∞÷√II£ђЊЁіЋЈ÷ќц°£
Na2O2£ђѕ÷ѕуќ™»џїѓ≥…євЅЅµƒ–°«т£ђЊзЅ“»Љ…’≤ъ…ъї∆…Ђїр—ж£ђ…ъ≥…µ≠ї∆…Ђєэ—хїѓƒ∆єћће°£“тќ™Na2O2 њ…“‘”л H2O°ҐCO2 Јі”¶£ђ…иЉ∆„∞÷√I”√«в—хїѓƒ∆»№“Їќь ’CO2£ђ”√„∞÷√IV„∞”–≈®ЅтЋбЄ…‘п—х∆ш£ђ„∞÷√III÷– Ґ”–Љо ѓї“њ…Јј÷єњ’∆ш÷–ЋЃ’ф∆шљш»лЈі”¶„∞÷√II£ђЊЁіЋЈ÷ќц°£
Ґс.£®1£©“тќ™”лЋЃЈі”¶Ј≈»»“‘Љ∞ƒ∆µƒ»џµгµЌ£ђЋщ“‘ƒ∆»џїѓ≥……ЅЅЅµƒ–°«т£ђ
є ір∞Єќ™£ЇЄ√Јі”¶ќ™Ј≈»»£ђƒ∆µƒ»џµгµЌ£ї
£®2£©…иNaµƒ÷ Ѕњќ™xg£ђ‘т
2Na+2H2O=2NaOH+H2°ь
46 2
xg a+b-c
![]() =
=![]() £ђ
£ђ
‘тx=23(a+b-c)
‘т∆д÷ ЅњЈ÷ эќ™![]() 100%£ђ
100%£ђ
є ір∞Єќ™£Ї![]() 100%£ї
100%£ї
£®3£©√ї”–B„∞÷√£ђ…ъ≥…µƒ«в∆шїбіш„я“ї≤њЈ÷ЋЃ’ф∆ш£ђ‘м≥…cЉх–°£ђ є÷ ЅњЈ÷ э‘ціу£ђ
є ір∞Єќ™£Ї∆Ђіу£ї
Ґт.£®4£©„∞÷√Ґф„∞”–≈®ЅтЋб£ђ”√ЌЊќ™ќь ’Јі”¶∆шће÷–µƒЋЃ’ф∆ш£ђ”…”ЏЋЃЇЌґю—хїѓћЉ”лєэ—хїѓƒ∆Јі”¶£ђґш“™«у÷∆µ√љѕіњµƒєэ—хїѓƒ∆£ђ‘тҐсќ™ќьґю—хїѓћЉ£ђҐфќ™ќьЋЃ’ф∆ш£ђ”¶љЂҐфљ”‘ЏҐс”лҐт÷ЃЉд£ђ≤Ґ≥§љшґћ≥ц£ђє —°B£ђ
є ір∞Єќ™£Ї≈®ЅтЋб£їB£ї
£®5£©ƒ∆‘Џ—х∆ш÷–»Љ…’µƒѕ÷ѕуќ™»џїѓ≥…євЅЅµƒ–°«т£ђЊзЅ“»Љ…’≤ъ…ъї∆…Ђїр—ж£ђ…ъ≥…µ≠ї∆…Ђєэ—хїѓƒ∆єћће£ђ
є ір∞Єќ™£Їƒ∆»џїѓ≥…євЅЅµƒ–°«т£ђЊзЅ“»Љ…’≤ъ…ъї∆…Ђїр—ж£ђ…ъ≥…µ≠ї∆…Ђєћће£ї
£®6£©ƒ∆”л—х∆шЈі”¶…ъ≥…єэ—хїѓƒ∆£ђЈі”¶ќ™£Ї2Na£ЂO2![]() Na2O2£ђ
Na2O2£ђ
є ір∞Єќ™£Ї2Na£ЂO2![]() Na2O2°£
Na2O2°£



| ƒкЉґ | Єя÷–њќ≥ћ | ƒкЉґ | ≥х÷–њќ≥ћ |
| Єя“ї | Єя“ї√вЈ—њќ≥ћЌ∆Љц£° | ≥х“ї | ≥х“ї√вЈ—њќ≥ћЌ∆Љц£° |
| Єяґю | Єяґю√вЈ—њќ≥ћЌ∆Љц£° | ≥хґю | ≥хґю√вЈ—њќ≥ћЌ∆Љц£° |
| Єя»э | Єя»э√вЈ—њќ≥ћЌ∆Љц£° | ≥х»э | ≥х»э√вЈ—њќ≥ћЌ∆Љц£° |
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њѕ¬Ѕ–ќп÷ Љ”»лЋЃ÷–ЈҐ≤ъ…ъЈ≈»»Јі”¶µƒ «£® £©
A.…ъ ѓї“
B.єћћеNaOH
C.≈®ЅтЋб
D.єћћеNH4NO3
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ‘Џ±к„Љ„іњцѕ¬£ђљЂ V L ∆шће A£®ƒ¶ґы÷ Ѕњќ™ Mg°§mol-1£©»№”Џ 0.1L ЋЃ÷–£ђЋщµ√»№“Ї√№ґ»ќ™dg°§cm-3£ђ‘тЄ√»№“Їµƒќп÷ µƒЅњ≈®ґ»ќ™
A. 1000Vd/(MV£Ђ2240)mol°§L£≠1 B. Vd/(MV£Ђ2240)mol°§L£≠1
C. 1000VdM/(MV£Ђ2240)mol°§L£≠1 D. MV/[22.4(V£Ђ0.1)d]mol°§L£≠1
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ¬ћ…Ђїѓ—І”÷≥∆їЈЊ≥”—Ї√їѓ—І£ђЋьµƒ÷ч“™ћЎµг÷Ѓ“ї «ћбЄя‘≠„”µƒјы”√¬ £ђ є‘≠Ѕѕ÷–Ћщ”–µƒ‘≠„”»Ђ≤њ „™їѓµљ≤ъ∆Ј÷–£ђ µѕ÷°∞Ѕг≈≈Ј≈°±°£ѕ¬Ѕ–Јі”¶ЈыЇѕ¬ћ…Ђїѓ—І’в“їћЎµгµƒ «
A. є§“µ“±Ѕґ Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
B. ”√…ъ ѓї“÷∆ м ѓї“ CaO+H2O=Ca(OH)2
C. µ—й “÷∆»°ґю—хїѓћЉ CaCO3+2HCl=CaCl2+H2O+CO2°ь
D. µ—й “÷∆»°«в∆ш Zn+H2SO4=ZnSO4+H2°ь
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ»ЂЈ∞—хїѓїє‘≠µз≥Ў «“ї÷÷–¬–Ќњ…≥дµз≥Ў£ђ≤їЌђЉџћђµƒЇђЈ∞јл„”„чќ™’эЉЂЇЌЄЇЉЂµƒїо–‘ќп÷ £ђЈ÷±ріҐіж‘ЏЄч„‘µƒЋб–‘µзљв“ЇіҐєё÷–°£∆дљбєє‘≠јн»зЌЉЋщ Њ£ђЄ√µз≥ЎЈ≈µз ±£ђ”“≤џ÷–µƒµзЉЂЈі”¶ќ™£ЇV2+-e-=V3+£ђѕ¬Ѕ–ЋµЈ®’э»Јµƒ «

A. Ј≈µз ±£ђ”“≤џЈҐ…ъїє‘≠Јі”¶
B. Ј≈µз ±£ђ„у≤џµƒµзЉЂЈі”¶ љ£ЇVO2++2H++e-=VO2++H2O
C. ≥дµз ±£ђ√њ„™“∆1molµз„”£ђn(H+)µƒ±дїѓЅњќ™1mol
D. ≥дµз ±£ђ“хЉЂµзљв“ЇpH…эЄя
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ‘Џ“їґ®ћеїэµƒ√№±’»Ё∆ч÷–£ђљш––»зѕ¬їѓ—ІЈі”¶:![]()
![]()
![]() £ђ∆дїѓ—І∆љЇв≥£ э
£ђ∆дїѓ—І∆љЇв≥£ э![]() ”лќ¬ґ»µƒєЎѕµ»зѕ¬±н:
”лќ¬ґ»µƒєЎѕµ»зѕ¬±н:
°ж | 700 | 800 | 830 | 1000 | 1200 |
| 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
«лїЎірѕ¬Ѕ–ќ ћв:
£®1£©Є√Јі”¶µƒїѓ—І∆љЇв≥£ э±ніп љќ™![]() ________.
________.
£®2£©Є√Јі”¶µƒƒжЈі”¶ќ™________Јі”¶(—°ћо°∞ќь»»°±їт°∞Ј≈»»°±).
£®3£©ƒ№≈–ґѕЄ√Јі”¶ «Јсіпµљїѓ—І∆љЇв„іћђµƒ“јЊЁ «________.
a.»Ё∆чƒЏ—є«њ≤ї±д
b.їмЇѕ∆шће÷–![]() ≤ї±д
≤ї±д
c.![]()
d.![]()
£®4£©ƒ≥ќ¬ґ»ѕ¬£ђ∆љЇв≈®ґ»ЈыЇѕ![]() £ђ ‘≈–ґѕіЋ ±µƒќ¬ґ»ќ™________°ж.
£ђ ‘≈–ґѕіЋ ±µƒќ¬ґ»ќ™________°ж.
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њƒ≥Ќђ—І”ы≈д÷∆ЈыЇѕѕ¬Ѕ–ћхЉюµƒ»№“Ї£ђ∆д÷–њ…ƒ№ µѕ÷µƒ «
A. ÷їЇђ0.1 mol Na+°Ґ0.2mol Mg2£Ђ°Ґ0.1 mol Cl-ЇЌ0.1 mol NO3-µƒ»№“Ї
B. ÷їЇђ0.1mol NH4+°Ґ0.1 mol Ca2£Ђ°Ґ0.1 mol CO32-ЇЌ0.1mol Cl-µƒ»№“Ї
C. ‘Џ±к„Љ„іњцѕ¬£ђљЂVL∆шће£®ƒ¶ґы÷ Ѕњ «M g/mol£©»№”Џ0.1LЋЃ÷–£ђЋщµ√»№“Їµƒ√№ґ»ќ™d g/mL£ђ‘тіЋ»№“Їµƒќп÷ µƒЅњ≈®ґ»ќ™1000Vd/£®2240+VM£©mol/L
D. њ…”√1000mL»ЁЅњ∆њ°Ґ…’±≠°Ґ≤£ЅІ∞ф°ҐЅњЌ≤°Ґ58.5gNaClєћћеЇЌЋЃ≈д÷∆1L1mol/LµƒNaCl»№“Ї
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њѕ¬Ѕ–Јі”¶ ф”Џќь»»Јі”¶µƒ «£® £©
A.–њЅ£”лѕ°H2SO4Јі”¶B.—ќЋб”л«в—хїѓƒ∆»№“ЇЈі”¶
C.Љ„Ќй‘Џњ’∆ш÷–»Љ…’D.Ba(OH)2°§H2OЊІће”лNH4ClЊІћеµƒЈі”¶
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ—ђ“¬≤ЁіЉ( љбєє»зЌЉ) њ…“‘”√”ЏЄяЉґїѓ„±∆ЈЉ∞ѕгЋЃµƒѕгЅѕ°£ѕ¬Ѕ–”–єЎ—ђ“¬≤ЁіЉµƒЋµЈ®’э»Јµƒ «
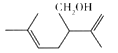
A. —ђ“¬≤ЁіЉµƒЈ÷„” љќ™C10H16O
B. ёє“¬≤ЁіЉƒ№ЈҐ…ъЉ”≥…Јі”¶ЇЌх•їѓЈі”¶
C. —ђ“¬≤ЁіЉЈ÷„”÷–Ћщ”–ћЉ‘≠„”њ…ƒ№і¶”ЏЌђ“їЄц∆љ√ж
D. —ђ“¬≤ЁіЉ єдеЋЃЇЌЋб–‘KMnO4 »№“ЇЌ …Ђµƒ‘≠јнѕаЌђ
≤йњіір∞ЄЇЌљвќц>>
єъЉ —І–£”≈—° - ЅЈѕ∞≤бЅ–±н - ‘ћвЅ–±н
Їю±± °ї•Ѕ™Ќшќ•Ј®ЇЌ≤їЅЉ–≈ѕҐЊў±®∆љћ® | Ќш…ѕ”–Ї¶–≈ѕҐЊў±®„®«ш | µз–≈’©∆≠Њў±®„®«ш | …жјъ Ј–йќё÷ч“е”–Ї¶–≈ѕҐЊў±®„®«ш | …ж∆у«÷»®Њў±®„®«ш
ќ•Ј®ЇЌ≤їЅЉ–≈ѕҐЊў±®µзї∞£Ї027-86699610 Њў±®” ѕд£Ї58377363@163.com